下列哪一种元素的氧化数为+IV的氧化物,通常是不稳定的()A、Ti(IV)B、V(IV)C、Cr(IV)D、Mn(IV)
题目
下列哪一种元素的氧化数为+IV的氧化物,通常是不稳定的()
- A、Ti(IV)
- B、V(IV)
- C、Cr(IV)
- D、Mn(IV)
相似问题和答案
第1题:
用元素氧化物的分解压来解释转炉吹炼初期元素氧化的顺序是( )。
第2题:
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸

,可得出以下结论:
外层电子排布
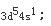
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为

Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。
第3题:
下列说法哪一种是不正确的
A、主族元素的最高化合价等于它所在的组的序数
B、同一主族元素的金属性随元素的核外电子数增加而增强
C、同一主族元素的非金属性随元素的周期数的增加而减弱
D、同一周期的主族元素的非金属性随主族数的增加而增强
E、同一周期的主族元素的最高氧化物对应的水化物酸性随主族数的增加而减弱
第4题:
氧化物的分解压愈大,此氧化物愈不稳定,()分解析出金属。
正确答案:愈容易
第5题:
在碳的一种氧化物中,碳元素与氧元素的质量比是3:8,则该氧化物中碳原子与氧原子的个数比也为3:8。
A对
B错
错
略
第6题:
B.Cr
C.Mo
D.S
第7题:
B.Ⅱ A族
C.ⅣA族
D.VIA族

(2)因质子数等于中子数,所以该元素的质子数即原子序数为28÷2=14.其元素原子的电

第8题:
已知下列元素在氧化物中的化合价,写出它们氧化物的化学式。(提示:元素符号
上方的数字是化合价。)
+2 +4 +2 S C Ba
+5 +2 +2 N Mg Ca
第9题:
在碳的一种氧化物中,碳元素与氧元素的质量比为3:8,则该氧化物中碳原子与氧原子的个数比也为3:8。
正确答案:错误
第10题:
下列哪一种元素的(Ⅴ)氧化态在通常条件下都不稳定()。
- A、Cr(Ⅴ)
- B、Mn(Ⅴ)
- C、Fe(Ⅴ)
- D、都不稳定
正确答案:D
