已知氨水在298K时的电离常数K=1.8×10-5,氨水溶液中[OH-]=2.40×10mol·L-1,这种氨水的浓度(mol·L-1)是()A、0.32B、0.18C、3.20D、1.80
题目
已知氨水在298K时的电离常数K=1.8×10-5,氨水溶液中[OH-]=2.40×10mol·L-1,这种氨水的浓度(mol·L-1)是()
- A、0.32
- B、0.18
- C、3.20
- D、1.80
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
在某温度时,已知0.100 mol/dm3的氢氰酸(HCN)的电离度为0.010%,该温度时HCN的标准电离常数 是:
是:
(A)1.0 ×10?5
(B)1.0 ×10?4
(C)1.0 ×10?9
(D)1.0 ×10?6
 是:
是:
(A)1.0 ×10?5
(B)1.0 ×10?4
(C)1.0 ×10?9
(D)1.0 ×10?6
答案:C
解析:

第2题:
已知氨水中的氨浓度为0.500mol/L,求溶液的pH值(Kb=1.8×10-5)
正确答案: 可应用近似公式求解
=3.0×10-3(mol/L)
pOH=-lg[OH-]=2.52
pH=14.00-pOH=11.48
第3题:
某酸在18℃时的平衡常数为1.84*10-5,在25℃时的平衡常数为1.87*10-5,则说明该酸()。
A.在18℃时溶解度比25℃小
B.的电离过程是吸热过程
C.温度高时电离度变小
D.温度高时溶液中的氢离子浓度变小
参考答案:B
第4题:
电离常数K表示弱电解质电离的能力,K愈小,表示电离程度愈()K随温度升高而()
正确答案:小;增大
第5题:
已知298K时△rGθ(CH3COOH,aq)=-396.6kJ·mol-1,△rGθ(CH3COO-,aq)=-369.4kJ·mol-1试求算室温下醋酸的电离平衡常数。并判断醋酸溶于水形成浓度为1mol·L-1的溶液时能否自发进行电离()。
- A、A1.6×10-5自发进行
- B、B1.7×10-5自发进行
- C、C1.7×10-5不能自发进行
- D、D1.6×10-5不能白发进行
正确答案:B
第6题:
某温度时,已知0.100mol/dm3氢氰酸(HCN)的电离度为0. 010%,该温度时HCN的标准电离常数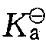 是:
是:
A. 1.0X10-5 B. 1.0X10-4 C. 1.0X10-9 D. 1.0X10-6
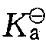 是:
是:
A. 1.0X10-5 B. 1.0X10-4 C. 1.0X10-9 D. 1.0X10-6
答案:C
解析:
提示:电离度α与电离常数的关系:Ka =Cα2/(1-α)。
第7题:
298K时0.0500mol·L-1NH4NO3溶液中,该盐的水解度是()已知:K=0.740×10-1,氨的K=1.75×10-5(不考虑H+的活度)
- A、9.20×10%
- B、9.25×10%
- C、9.30×10%
- D、9.35×10%
正确答案:A
第8题:
某温度时,已知0.100mol/dm3氢氰酸(HCN)的电离度为0. 010%,该温度时HCN的标准电离常数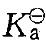 是:
是:
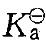 是:
是:
A. 1.0X10-5
B. 1.0X10-4
C. 1.0X10-9
D. 1.0X10-6
B. 1.0X10-4
C. 1.0X10-9
D. 1.0X10-6
答案:C
解析:
提示:电离度a与电离常数的关系:Ka=Ca2/(1-a)。
第9题:
根据电势图计算在298K时,Br2在碱性水溶液中歧化为Br-和BrO3-的反应平衡常数。
正确答案: 由公式:-ZFE=-RTlnK
得:K=exp(ZFE/RT)
=2.92×1038
第10题:
下述反应在298K时的△rH°为284.5KJ/mol,已知此反应的平衡常数K=10-54,试计算该反应的△rG°和△rS° 3O3→2O2
正确答案: △rG°=308(KJ/mol) △rS°= -78.86(J/mol/K)
