如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
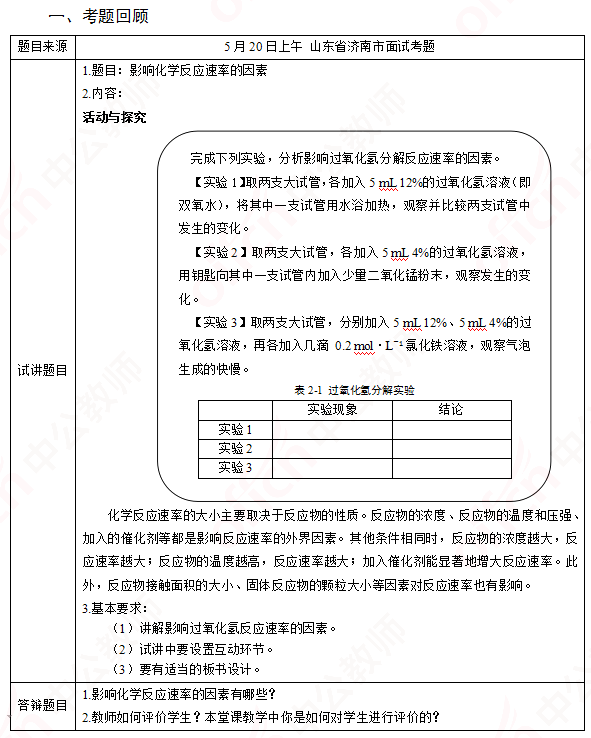
高中化学《影响化学反应速率的因素》
二、考题解析
【教学过程】
(一)图片导入
【展示图片】面包的标签。请学生观察保质期。
【提出问题】根据生活常识知道在不同温度条件下,面包的保质期长短不同,那么温度是如何影响化学反应的快慢?除了温度还有哪些因素会影响化学反应的快慢呢?
(二)探究新知
【展示图片】请学生回忆初中学过的不同金属单质(镁、铝、锌、铁)与稀盐酸的反应。
【提出问题】在外界条件相同的情况下,不同的金属单质与稀盐酸反应,它们的快慢并不相同,这说明了什么?
【学生回答,教师总结】决定化学反应快慢的主要因素是反应物本身的性质。
【教师引导】那么外界条件对化学反应速率的影响是怎样的呢?能不能通过实验验证温度、催化剂、浓度对化学反应速率的影响呢?请同学们利用实验台上的药品、仪器等设计实验。接下来同学们以分好的实验小组为单位,讨论一下如何设计实验,7分钟之后请小组代表回答设计的方案。
(学生小组讨论环节)
【学生回答】①温度对化学反应速率的影响:控制其他外界条件相同,观察相同浓度的双氧水在不同温度下分解的反应速率;
②催化剂对化学反应速率的影响:控制其他外界条件相同,观察相同浓度的双氧水分别加入催化剂、不加入催化剂的反应速率;
③浓度对化学反应速率的影响:观察不同浓度的双氧水在相同条件的反应速率。
【教师引导】在做实验的时候注意控制好外界条件,各个小组按照自己小组设计的实验方案来进行实验,在实验的时候注意观察实验现象,并由此判断外界条件对化学反应速率的影响是怎样的。
(学生分组实验环节,教师巡视指导。)
【学生回答,小组总结】①温度对化学反应速率的影响:温度影响化学反应的速率,温度越高化学反应速率越快,反之越慢;
②催化剂对化学反应速率的影响:催化剂影响化学反应的速率,催化剂可以大大加快反应的速率;
③浓度对化学反应速率的影响:浓度影响化学反应的速率,浓度越大反应速率越大。
【提出问题】下列事实中,什么因素影响了化学反应的速率?
(1)铁矿石炼铁时要粉碎成矿粒。
(2)实验室进行化学反应时,常常把一些固体物质溶于水配成溶液再进行反应。
(3)工业合成氨,通常在2×107~5×107Pa的压强下进行。
【小组回答】
①反应物表面积:有固体参加的反应,固体的表面积越大,化学反应速率越快。
②反应物状态:通常气相或液相反应比固相反应的反应速率大。
③压强:对于有气体参加的反应,改变压强将使气体的体积发生改变,即相应地改变气体的浓度。
(三)拓展提升
【教师提问】在超市,为什么有很多的食品放置在冰柜当中,有什么作用?
【学生回答】通过降低温度有助于减慢化学反应速率,防止食品变质。
(四)小结作业
小结:总结影响化学反应速率的因素。
作业:调查生活生产中改变外界因素调节反应速率的实例,并用化学知识解释。

【答辩题目解析】
1.影响化学反应速率的因素有哪些?
2.教师如何评价学生?本堂课教学中你是如何对学生进行评价的?

二、考题解析
【教学过程】
(一)图片导入
【展示图片】面包的标签。请学生观察保质期。
【提出问题】根据生活常识知道在不同温度条件下,面包的保质期长短不同,那么温度是如何影响化学反应的快慢?除了温度还有哪些因素会影响化学反应的快慢呢?
(二)探究新知
【展示图片】请学生回忆初中学过的不同金属单质(镁、铝、锌、铁)与稀盐酸的反应。
【提出问题】在外界条件相同的情况下,不同的金属单质与稀盐酸反应,它们的快慢并不相同,这说明了什么?
【学生回答,教师总结】决定化学反应快慢的主要因素是反应物本身的性质。
【教师引导】那么外界条件对化学反应速率的影响是怎样的呢?能不能通过实验验证温度、催化剂、浓度对化学反应速率的影响呢?请同学们利用实验台上的药品、仪器等设计实验。接下来同学们以分好的实验小组为单位,讨论一下如何设计实验,7分钟之后请小组代表回答设计的方案。
(学生小组讨论环节)
【学生回答】①温度对化学反应速率的影响:控制其他外界条件相同,观察相同浓度的双氧水在不同温度下分解的反应速率;
②催化剂对化学反应速率的影响:控制其他外界条件相同,观察相同浓度的双氧水分别加入催化剂、不加入催化剂的反应速率;
③浓度对化学反应速率的影响:观察不同浓度的双氧水在相同条件的反应速率。
【教师引导】在做实验的时候注意控制好外界条件,各个小组按照自己小组设计的实验方案来进行实验,在实验的时候注意观察实验现象,并由此判断外界条件对化学反应速率的影响是怎样的。
(学生分组实验环节,教师巡视指导。)
【学生回答,小组总结】①温度对化学反应速率的影响:温度影响化学反应的速率,温度越高化学反应速率越快,反之越慢;
②催化剂对化学反应速率的影响:催化剂影响化学反应的速率,催化剂可以大大加快反应的速率;
③浓度对化学反应速率的影响:浓度影响化学反应的速率,浓度越大反应速率越大。
【提出问题】下列事实中,什么因素影响了化学反应的速率?
(1)铁矿石炼铁时要粉碎成矿粒。
(2)实验室进行化学反应时,常常把一些固体物质溶于水配成溶液再进行反应。
(3)工业合成氨,通常在2×107~5×107Pa的压强下进行。
【小组回答】
①反应物表面积:有固体参加的反应,固体的表面积越大,化学反应速率越快。
②反应物状态:通常气相或液相反应比固相反应的反应速率大。
③压强:对于有气体参加的反应,改变压强将使气体的体积发生改变,即相应地改变气体的浓度。
(三)拓展提升
【教师提问】在超市,为什么有很多的食品放置在冰柜当中,有什么作用?
【学生回答】通过降低温度有助于减慢化学反应速率,防止食品变质。
(四)小结作业
小结:总结影响化学反应速率的因素。
作业:调查生活生产中改变外界因素调节反应速率的实例,并用化学知识解释。

【答辩题目解析】
1.影响化学反应速率的因素有哪些?
2.教师如何评价学生?本堂课教学中你是如何对学生进行评价的?
答案:
解析:
1、影响化学反应的速率分为内因和外因。内因是影响化学反应速率的本质也就是物质本身的性质,外因有反应物的浓度、温度、压强、催化剂。另外反应物的状态,比如块状还是粉末状,有没有搅拌等也会影响化学反应的速率。
2、新课改理念要求教师注重对学生的情感、态度、价值观等方面进行综合评价。“评价”是学校教育教学活动中的一个重要环节。学校要建立评价学生全面发展的指标体系,不仅要关注学生的学业成绩,而且要注重发展和发现学生多方面的潜能和特长,如学生的道德品质、学习的愿望和能力、交流与合作、个性与情感以及创新意识和实践能力等。要采用灵活多样、具有开放性的评价方法,要关注过程性评价,帮助学生认识自我、建立自信,激发其内在的发展动力,使学生全面发展健康成长。本节课通过启发式的提问,引导学生思考,对于思考速度稍慢的同学我会耐心指导,在小组讨论中,我也会下去巡视,时时关注学生的讨论情况,并及时纠正和引导。
2、新课改理念要求教师注重对学生的情感、态度、价值观等方面进行综合评价。“评价”是学校教育教学活动中的一个重要环节。学校要建立评价学生全面发展的指标体系,不仅要关注学生的学业成绩,而且要注重发展和发现学生多方面的潜能和特长,如学生的道德品质、学习的愿望和能力、交流与合作、个性与情感以及创新意识和实践能力等。要采用灵活多样、具有开放性的评价方法,要关注过程性评价,帮助学生认识自我、建立自信,激发其内在的发展动力,使学生全面发展健康成长。本节课通过启发式的提问,引导学生思考,对于思考速度稍慢的同学我会耐心指导,在小组讨论中,我也会下去巡视,时时关注学生的讨论情况,并及时纠正和引导。
第2题:
扩散过程对CO变换反应有什么影响?
正确答案: 对于变换反应,内扩散的影响是不容忽视的。内表面利用率不仅与与催化剂的尺寸、结构及反应活性有关,而且与操作温度及压力等因素有关,对同一尺寸的催化剂,在相同压力下由于温度升高,CO扩散速度有所增加,但在催化剂表面反应的速度常数增加更为迅速,总的结果是温度升高,内表面利有率降低。在相同温度及压力下,小颗粒的催化剂具有较高的内表面利用率,这是因为催化剂尺寸越小,毛细孔的长度越短,内扩散阻力越小,故内表面利用率较高。对于同一尺寸的中变催化剂,在相同温度下,随着压力的提高,反应速度增大,而CO有效扩散系数又显著变小,故内表面利用率随压力的增加而迅速下降。
第3题:
一般温度升高,化学反应速率加快。如果活化能越大,则反应速率受温度的影响也越大。()
此题为判断题(对,错)。
参考答案:正确
第4题:
温度变化对变换反应有何影响?
正确答案:只有在一定温度下变换反应才能发生,在一定的温度范围内,反应温度越低,变换反应的平衡常数和反应热越大,所以为了获得更多的氢气,二氧化碳和反应热,应当尽是降低反应温度。一般选择低温活性好的催化剂。
第5题:
反应温度改变时,对反应的速率、速率常数、平衡常数等均有影响。下列叙述中哪一个是错误的()?
- A、反应温度升高,正、逆反应速率均增加
- B、对吸热反应,温度升高使平衡向右移动
- C、对放热反应,温度升高使平衡常数增加
- D、温度升高使速率常数增加
正确答案:C
第6题:
温度点TI3003或高或低对变换炉有何影响?控制室人员将如何操作才能稳定变换炉的温度?
正确答案: T.I3003或高或低直接影响变换炉床层温度,温度过高会使变换炉炉温上涨,严重时变换炉超温甚至爆炸事故;温度过低,床层温度下降,严重时炉温会拉垮,造成停车;变换炉床层温度波动,会影响一氧化碳的调节及变换触媒的活性和使用寿命。
控制室操作:如因水汽比波动造成,调节PV3002的压力来稳定水汽比;利用TV3003自调及副线来调整;控制好在系统加减量时一定要缓慢,严禁气量大幅度增加或减少;适当调节E3002的入口阀;水煤气副线调节幅度要小、勤;控制好入工段温度及入工段分离器的液位,严禁带水进入变换炉;联系仪表及时对TI3003进行校核。
第7题:
试述浓度、压强和温度如何影响化学平衡和化学反应速率?
正确答案: 在其他条件不变的情况下,增加反应物浓度或减少生成物浓度,化学平衡向正反应方向移动;增加生成物浓度或者减少反应物浓度,化学平衡向着逆反应的方向移动。增大反应物的浓度,也可以增大化学反应速率。
对有气体参与的反应,若反应前后气体分子数不相等,则在等温下,增大总压强,平衡向气体分子数减少的方向移动;减压,则平衡向气体分子数增加的方向移动。增大压强,也可以增大化学反应速率。
温度的影响与反应的热效应有关,升高温度,使平衡向吸热方向移动;降低温度,使平衡向放热方向移动。升高温度,也可以增大化学反应速率。
第8题:
对CO变换反应,下列说法正确的是( )、
A. 高温和高水碳比有利于平衡右移
B. 变换反应是可逆放热反应
C. 变换过程采用单反应器
D. 压力对平衡和反应速度都无影响
参考答案B
第9题:
温度对变换反应的平衡有何影响?
正确答案:一氧化碳的变换反应是一个可逆放热反应,根据化学平衡移动原理,温度降低,平衡向着生成二氧化碳和水蒸汽的方向移动,这就说明,温度愈低,出口一氧化碳愈低,因此,从反应平衡方面考虑,变换反应须控制在较低的温度下操作。
第10题:
温度对反应速率的影响()。
- A、反应速率常数随温度升高而很快增大
- B、温度升高只影响正向反应速率
- C、阿累尼乌斯公式反映了浓度对反应速率的影响
- D、化学反应速率常数不随温度变化
正确答案:A
