设弱酸HA的电离度为α,0.1mol/L溶液中的氢离子的浓度是:()A、αmol/LB、0.1αmol/LC、0.01αmol/LD、0.001αmol/LE、0.0001αmol/L
题目
设弱酸HA的电离度为α,0.1mol/L溶液中的氢离子的浓度是:()
- A、αmol/L
- B、0.1αmol/L
- C、0.01αmol/L
- D、0.001αmol/L
- E、0.0001αmol/L
相似问题和答案
第1题:
A.10-3
B.10-6
C.10-7
D.10-4
第2题:
在1MOL/L的醋酸溶液中,存在着HAC <=>H++AC-的电离平衡,要使溶液中氢离子浓度增大,并且醋酸的电离度减小,可采用( )。
A.加NAOH
B.加水
C.加冰醋酸
D.加醋酸钠
第3题:
pH值的定义是
A、溶液中氢氧根离子浓度的对数
B、溶液中氢离子活度的对数
C、溶液中氢离子活度的负对数
D、溶液中氢离子浓度的对数
E、溶液中氢离子浓度的负对数
第4题:
对pH的定义,下列哪项最准确()。
- A、溶液中氢离子浓度的对数
- B、溶液中氢氧根离子浓度的对数
- C、溶液中氢离子活度的负对数
- D、溶液中氢离子活度的对数
- E、溶液中氢离子浓度的负对数
正确答案:C
第5题:
有一弱酸HR,在0.1mol·L-1的溶液中有2%电离,试确定该酸在0.05mol·L-1溶液中的电离度()
- A、4.1%
- B、4%
- C、2.8%
- D、3.1%
正确答案:C
第6题:
浓度为0.1mol/L的某弱酸弱碱盐NH4A溶液pH=7.00,则HA的pKa为( )。
(已知:NH3·H2O的Kb=1.8×10-5)
求计算过程
答案:
NH4A在质子论当作两性物质 [H+]=约=[Ka(NH4+) *Ka(HA)]^1/2 [H+]^2 =Ka(NH4+)* Ka(HA) 而Ka(NH4+)=Kw/Kb(NH3) 因此 [H+]^2 =Kw/ Kb(NH3)* Ka(HA) (10^-7)^2=10^-14 /Kb(NH3)* Ka(HA) 即:Ka(HA)=Kb(NH3)=1.8*10^-5。
第7题:
B.加H2O稀释后,HAc的电离度增加
C.加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加
D.加入少量HCl,使HAc电离度减小
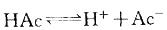 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: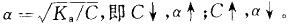 。
。第8题:
A、0.1
B、0.2
C、0.05
D、0.25
第9题:
0.2mol/L的HAc溶液中的氢离子浓度是0.1mol/LHAc溶液中氢离子浓度的两倍。17.
正确答案:错误
第10题:
pH的定义是()。
- A、溶液中氢氧根离子浓度的对数
- B、溶液中氢离子活度的对数
- C、溶液中氢离子活度的负对数
- D、溶液中氢离子浓度的对数
- E、溶液中氢离子浓度的负对数
正确答案:C
