如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
在元素周期表中,同周期元素从左到右,金属性逐渐减弱,非金属性逐渐增强,最后以稀有元素结尾。()
此题为判断题(对,错)。
答案:对
第2题:
依据下列说法判断相应元素的金属性,非金属性强弱,不合理的是()。
A.卤素单质Cl2、Br2、I2与H2化合的难易程度
B.Fe能与CuSO4溶液发生置换反应
C.碱金属单质K、Na、Li与水反应的剧烈程度
D.HClO3、H2SO4、H3PO4的酸性强弱
B.Fe能与CuSO4溶液发生置换反应
C.碱金属单质K、Na、Li与水反应的剧烈程度
D.HClO3、H2SO4、H3PO4的酸性强弱
答案:D
解析:
非金属单质的氧化性越强,其与H2化合越容易,A项正确;一种金属与另一种金属的可溶性盐溶液混合,根据其是否发生置换反应,可判断二者金属性强弱,b项正确;碱金属单质与水反应越剧烈,表明金属性越强,C项正确;根据非金属元素的最高价氧化物对应的水化物的酸性强弱,可判断相应元素的非金属性强弱。HClO3不是Cl元素最高价氧化物对应的水化物,故D项不合理。
第3题:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
正确答案:B
【解析】根据X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,综合判断知X为Na、Z为O、Y为Cl,B项中的离子半径应为:Z2->X+。
【考点分析】考查元素的推断和元素周期律。
【解析】根据X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,综合判断知X为Na、Z为O、Y为Cl,B项中的离子半径应为:Z2->X+。
【考点分析】考查元素的推断和元素周期律。
第4题:
下列元素中,其化合物常具有颜色的是()
- A、碱金属
- B、碱土金属
- C、过渡元素
- D、惰性气体
- E、p区元素
正确答案:C
第5题:
碱金属中()离子的极化力最强,()变形性最大
正确答案:Li+;Cs+
第6题:
根据已有知识“碱金属具有很强的金属性.能与水发生剧烈反应”“铯是碱金属元素”,由此可以推出“铯也能与水发生剧烈反应”。这里用到的逻辑思维方法是( )。
A、演绎
B、归纳
C、类比
D、比较
B、归纳
C、类比
D、比较
答案:A
解析:
演绎是从一般到特殊的逻辑推理方法。归纳是从特殊到一般的逻辑推理方法。类比是根据两个或两类对象有某些共有或相似属性推出一个研究对象可能具有另一个研究对象所具有的属性.是从个别到个别或从特殊到特殊的逻辑推理方法。比较是指找出对象间的异同.认识比较对象间的内在联系。题干运用的是演绎思维方法.故本题选A。
第7题:
依据下列说法判断相应元素的金属性,非金属性强弱,不合理的是( )


答案:D
解析: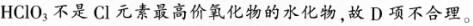
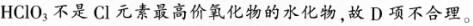
第8题:
关于元素周期表与周期律,下列说法正确的是
A、元素的性质随着原子量的递增,呈周期性变化
B、在元素周期表中,族序数都等于该元素的原子的最外层电子数
C、在元素周期表中,非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强
D、随着核电荷数的递增,元素原子半径依次增大
E、ⅦA族单质自上而下,随原子量的增大,溶沸点升高
参考答案:E
第9题:
下列元素中,非金属性最强的是()。
- A、氧
- B、磷
- C、碳
- D、硅
正确答案:A
第10题:
氟表现出最强的非金属性,具有很大的化学反应活性,是由于()
- A、氟元素电负性最大,原子半径小
- B、单质熔、沸点高
- C、氟分子中F--F键离解能高
- D、分子间的作用力小
- E、单质氟的氧化性强
正确答案:A,E
