下列溶液中,属缓冲体系的是()。A、0.100mol·dm-3的NH4Cl溶液B、0.100mol·dm-3的CH3COONa溶液C、0.400mol·dm-3的HCl与0.200mol·dm-3的NH3等体积混合后的溶液D、0.400mol·dm-3的NH3与0.200mol·dm-3的HCl等体积混合后的溶液
题目
下列溶液中,属缓冲体系的是()。
- A、0.100mol·dm-3的NH4Cl溶液
- B、0.100mol·dm-3的CH3COONa溶液
- C、0.400mol·dm-3的HCl与0.200mol·dm-3的NH3等体积混合后的溶液
- D、0.400mol·dm-3的NH3与0.200mol·dm-3的HCl等体积混合后的溶液
参考答案和解析
正确答案:D
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
各物质浓度均为0.10mol·dm-3的下列水溶液中,其pH值最小的是:
(已知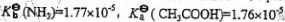 )
)
(A)NH4Cl (B)NH3
(C)CH3COOH (D)CH3COOH+CH3COONa
(已知
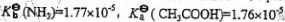 )
)
(A)NH4Cl (B)NH3
(C)CH3COOH (D)CH3COOH+CH3COONa
答案:C
解析:
NH3 呈若碱性,NH4C1 溶液呈酸性,Ka(NH4Cl)> Ka(CH3COOH))酸性CH3COOH> NH4Cl 在CH3COOH 中加入CH3COONa,由于同离子效应,使CH3COOH 解离度降低,酸性减少, 因此酸性CH3COOH> CH3COOH+CH3COONa.
第2题:
在某温度时,下列溶液体系中属缓冲溶液的是:
A. 0.100mol/dm3的NH4Cl溶液
B. 0.100mol/dm3的NaAC溶液
C. 0.400mol/dm3的HCl与0.200mol/dm3的NH3 . H2O等体积混合后的溶液
D. 0.400mol/dm3的NH3H2O与0.200mol/dm3的HCl等体积混合后的溶液
B. 0.100mol/dm3的NaAC溶液
C. 0.400mol/dm3的HCl与0.200mol/dm3的NH3 . H2O等体积混合后的溶液
D. 0.400mol/dm3的NH3H2O与0.200mol/dm3的HCl等体积混合后的溶液
答案:D
解析:
提示:NH3 过量,反应后形成NH3 * H2O-NH4Cl缓冲溶液。
第3题:
向等体积的浓度均为1mol·dm-3HAc和NaAc混合溶液中加入0.01mol·dm-3的HCl溶液0.005ml,则溶液PH值的改变为()
A、增大
B、减小
C、基本不变
D、无法确定
参考答案:C
第4题:
用0.20mol·dm-3 HAc和0.20mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3 pH=5.00的缓冲溶液,需取0.20mol·dm-3 HAc溶液为() (pKa(HAc)=4.75)
- A、6.4×102cm3
- B、6.5×102cm3
- C、3.5×102cm3
- D、3.6×102cm3
正确答案:D
第5题:
在某温度时,下列体系属于缓冲溶液的是( )。
A. 0.100mol/L的NH4Cl溶液
B. 0.100mol/L 的 NaAc 溶液
C. 0.400mol/L 的 HCl 与 0.200mol/L NH3 ~ H2O 等体积混合的溶液
D. 0.400 mol/L 的 NH3 ~ H2O 与 0.200mol/LHCl 等体积混合的
A. 0.100mol/L的NH4Cl溶液
B. 0.100mol/L 的 NaAc 溶液
C. 0.400mol/L 的 HCl 与 0.200mol/L NH3 ~ H2O 等体积混合的溶液
D. 0.400 mol/L 的 NH3 ~ H2O 与 0.200mol/LHCl 等体积混合的
答案:D
解析:
提示:共轭酸碱对可组成缓冲溶液。NH4Cl 为一元弱酸,NaAc为一元弱碱,C 中,HCl与NH3反应完全后,HCl 过量,故为HCl 和生成的NH4Cl 的混合溶液,D中HCl 与NH3反应完全后,NH3过量,过量的NH3?H2O与生成的NH4Cl 组成缓冲溶液,故选D。
第6题:
难溶电解质BaCO3在下列系统中溶解度最大的是:
(A)0.1mol·dm-3 HAc 溶液 (B)纯水 (C)0.1mol·dm-3 BaCl2溶液 (D)0.1mol·dm-3 Na2CO3溶液
(A)0.1mol·dm-3 HAc 溶液 (B)纯水 (C)0.1mol·dm-3 BaCl2溶液 (D)0.1mol·dm-3 Na2CO3溶液
答案:A
解析:
BaCl2、Na2CO3溶液,由于同离子效应,使平衡向左移动,BaCO3溶解度比在水中减少,A 项中HAc解离的H+离子,与CO2反应,生成H2CO3,H2CO3分解成CO2从溶液中析出,从而 使平衡向右,即溶解的方向移动,导致BaCO3的溶解度增大
第7题:
在20mL浓度为0.005mol·dm-3的AgNO3溶液中,滴入20mL浓度为0.01mol·dm-3的KBr溶液,可制备AgBr溶胶,则该溶胶的ξ电势()。
A.大于零
B.等于零
C.小于零
D.无法确定
B.等于零
C.小于零
D.无法确定
答案:C
解析:
第8题:
在由等体积的0.08mol·dm-3的KI和0.10 mol·dm-3的 AgNO3溶液配制的AgI溶胶中,分别加入浓度相同的下述电解质溶液,请由大到小排出其聚沉能力的大小次序。(1)NaCl; (2)Na2SO4; (3)Mg SO4; (4)K3[Fe(CN)6]
参考答案:其聚沉能力的大小次序为:(4)>(2)>(3)>(1)
第9题:
将0.400mol/L的NH3· H2O与0.200mol/L HCl等体积混合,在混合后的溶液中加入少量强酸,则溶液的pH值将( )。
A.显著降低 B.显著增加 C.保持相对稳定 D.不变
A.显著降低 B.显著增加 C.保持相对稳定 D.不变
答案:C
解析:
提示:弱酸及弱酸盐或弱碱及弱碱盐等共轭酸碱对可组成缓冲体系,HCl与NH3·H2O反应后生成NH4Cl,但过剩的是NH3,过量的NH3与生成的NH4Cl组成缓冲溶液,即混合后的溶液为NH3-NH4Cl缓冲体系,因此可抵抗少量强酸或强碱,而本身的pH值基本保持不变。
第10题:
把下列溶液的[H+]换算成pH:(1)某人胃液的[H+]=4.0×10-2mol·dm-3 (2)人体血液的[H+]=4.0×10-8mol·dm-3 (3)食醋的[H+]=1.26×10-3mol·dm-3 (4)番茄汁的[H+]=3.2×10-4mol·dm-3
正确答案: (1)[H+]=4.0×10-2,pH=1.40
(2)[H+]=4.0×10-8,pH=7.40
(3)[H+]=1.26×10-3,pH=2.90
(4)[H+]=3.2×10-4,pH=3.50。
