新药进行临床试验必须提供:A、急性毒性观察结果B、药物的成本C、慢性毒性观察结果D、系统药理研究数据E、临床前研究资料
题目
新药进行临床试验必须提供:
- A、急性毒性观察结果
- B、药物的成本
- C、慢性毒性观察结果
- D、系统药理研究数据
- E、临床前研究资料
相似问题和答案
第1题:
临床试验分为I、Ⅱ、Ⅲ、Ⅳ期。申请新药注册时( )。
A.必须进行I、Ⅱ、Ⅲ、Ⅳ期临床实验
B.可以只进行I、Ⅱ期临床实验
C.可以只进行Ⅱ、Ⅲ期临床试验
D.可以只进行Ⅲ、Ⅳ期临床试验
E.可以只进行Ⅱ、Ⅳ期临床试验
第2题:
临床试验分为I、Ⅱ、Ⅲ、Ⅳ期,申请新药注册时
A.必须进行I、Ⅱ、Ⅲ、Ⅳ期临床试验
B.可以只进行I、Ⅱ期临床试验
C.可以只进行Ⅱ、Ⅲ期临床试验
D.可以只进行Ⅲ、Ⅳ期临床试验
E.可以只进行Ⅱ、Ⅳ期临床试验
第3题:
新药临床试验应遵循四个必须,其中包括
A.必须有国务院的批准
B.必须遵守赫尔辛基宣言
C.必须符合GCP
D.必须在中检所进行试验
E.必须符合GMP
略
第4题:
B.急慢性毒性观察结果
C.新药作用谱
D.LD
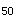
E.临床前研究资料
第5题:
B.新药非临床试验申请、新药生产申请
C.新药非临床试验申请、新药临床试验申请、新药生产申请
D.新药生产申请
E.新药临床试验申请、新药生产申请
第6题:
新药进行临床试验必须提供()
A.系统药理研究数据
B.新药作用谱
C.临床前研究资料
D.LD50
E.急慢性毒理研究数据
第7题:
目的是观察人体对于新药的耐受程度和药代动力学。为制定给药方案提供依据的是
A.I期临床试验
B.Ⅱ期临床试验
C.Ⅲ期临床试验
D.Ⅳ期临床试验
E.生物等效性试验
略
第8题:
新药技术转让应在( )。
A.获得新药证书后申请
B.新药正式生产后进行申请
C.新药获得批准文号后进行
D.新药试行标准转正后申请
E.新药Ⅲ期临床试验后开始申请
第9题:
B.Ⅱ期临床试验
C.Ⅲ期临床试验
D.Ⅳ期临床试验
E.Ⅴ期临床试验
第10题:
B.申请新药注册应进行临床试验或生物等效性试验
C.临床试验分四期
D.申请新药可进行Ⅰ、Ⅱ、Ⅲ期临床试验,有时可进行Ⅱ、Ⅲ期或Ⅲ期临床试验
