相似问题和答案
第1题:
此题为判断题(对,错)。
第2题:
一、考题回顾
题目来源1月6日上午 吉林省白城市面试考题
试讲题目1.题目:元素周期表
2.内容:
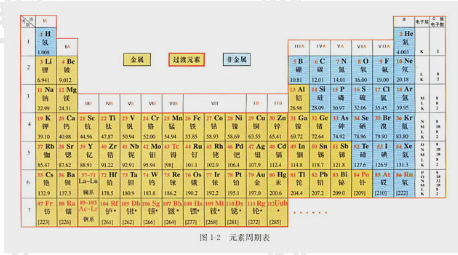
在周期表中,把电子层数相同的元素,按原子序数递增的顺序从左至右排成横行,再把不同横行中最外层电子数相同的元素,按照电子层递增的顺序由上而下排成纵行。
元素周期表有7个横行,叫做周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
在周期表中有些族的元素还有一些特别的名称。例如:
第ⅠA族(除氢):碱金属元素
第ⅦA族:卤族元素
0族:稀有气体元素
3.基本要求:
(1)讲解直观,通俗易懂。
(2)重点讲解元素周期表的特点。
(3)板书工整有条理。
(4)要有提问环节
答辩题目1.简要概述元素周期表中元素的金属性和非金属性变化的规律
2.本节课的教学重难点是什么?
二、考题解析
【教学过程】
(一)故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
(二)新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
【教师提问】从周期表中,大家还可以发现哪些信息?
【学生回答】还可以看出每种原子的元素符号,相对原子质量。
【引导观察】周期表中哪些族有特殊的名称。
【学生回答】第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素
(三)拓展提高
【学生活动】画出前4周期的图,并填上原子。
(四)小结作业
小结:引导学生共同总结本节课的内容。
作业:思考同一周期或者同一主族的元素的化学性质有什么规律。
【板书设计】

1.简要概述元素周期表中元素的金属性和非金属性变化的规律。
2.本节课的教学重难点是什么?
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
2.
周期表的知识是对前面学习的知识的整合,是后续学习元素周期律的基础,因此本节课的教学重点是认识周期、主族和副族。
周期表所包含的信息较多,虽然学生在初中有简单的了解过,但是其所包含的信息相对较为抽象,需要一定的基础能力,学生比较难掌握全部,因此本节课的教学难点是能够用元素周期表中的位置来表示元素。
第3题:
关于元素周期表与周期律,下列说法正确的是
A、元素的性质随着原子量的递增,呈周期性变化
B、在元素周期表中,族序数都等于该元素的原子的最外层电子数
C、在元素周期表中,非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强
D、随着核电荷数的递增,元素原子半径依次增大
E、ⅦA族单质自上而下,随原子量的增大,溶沸点升高
第4题:
阅读下面文字,回答相关问题。 元素周期表是元素周期律的具体表现形式,是我们学习化学的工具。元素在周期表中的位置,反映了元素的原子结构和元素的性质。我们可以根据元素在周期表中的位置推测其原子结构和性质,也可以根据元素的原子结构推测它在周期表中的位置。 请回答下列问题: (1)有人说"氦的最外层电子数为2,应该把它放在第ⅡA族",你认为这样编排元素周期表有何利弊? (2)结合化学教学实践,论述三序结合的原则在化学教材编写中"原子结构和元素周期表"理论部分的应用。
正确答案: (1)利:符合同族元素最外层电子数相等的规律等。弊:与同族其他元素性质相差悬殊等。
(2)依据三序结合的原则,理论前部分为卤族元素,采用了由个别到一般,由个性到共性的归纳方式,符合高一学生的认知过程和心理发展过程及知识体系:理论后部分为氧族元素、氮族元素,采用了一般到个别,共性到个性的演绎方式,符合高一后半学期学生的心理发展,已经具有了一定的抽象逻辑思维能力。发挥理论的指导作用,培养学生的能力,有利于个体发展。
第5题:
下列元素中,非金属性最强的是()。
- A、氧
- B、磷
- C、碳
- D、硅
正确答案:A
第6题:
B、定律
C、理论
D、模型
第7题:
B.元素周期表是俄国化学家门捷列夫编制的
C.今年是化学元素周期表创建150周年
D.元素周期表中元素是按原子从大到小排列的
第二步,化学元素周期表中的化学元素是按照由小到大的顺序排列的,因此选项描述不正确。
因此,选择D选项。
第8题:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
【解析】处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;H+的最外层电子分别是0,C项错误;同一主族的元素的原子最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不完全相同学,D错误。
第9题:
参加生物体组成的元素,总数(),在元素周期表中分布在元素周期表的(),即属于相对原子量较轻的一批元素。
正确答案:30多种;上部和中间部分
第10题:
在元素周期表中,同周期元素从左到右,金属性逐渐减弱,非金属性逐渐增强,最后以稀有元素结尾。
正确答案:正确
