1869年,已知的化学元素达63种,而且这期间的研究表明,元素的原子量和化学性质之间有着一定的关系。原子---分子论确立以后,化学上又一个重大的突破是()A、元素周期表的发现B、地球周期表的发现C、潮汐周期表的发现D、月亮周期变化的发现
题目
1869年,已知的化学元素达63种,而且这期间的研究表明,元素的原子量和化学性质之间有着一定的关系。原子---分子论确立以后,化学上又一个重大的突破是()
- A、元素周期表的发现
- B、地球周期表的发现
- C、潮汐周期表的发现
- D、月亮周期变化的发现
参考答案和解析
正确答案:A
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
1869年,已知的化学元素达63种,而且这期间的研究表明,元素的原子量和化学性质之间有着一定的关系。原子---分子论确立以后,化学上又一个重大的突破是()
A.元素周期表的发现
B.地球周期表的发现
C.潮汐周期表的发现
D.月亮周期变化的发现
参考答案:A
第2题:
阅读下列素材。回答有关问题:
1868年,化学家迈尔研究已知元素的原子量与其物理性质的关系时。把性质相近的元素划分为一个族.并与l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行。同年,他公布了他的第一张元素周期表,后来他汲取了迈尔周期表的优点,进行了更详细的族的划分】分,并于1871年公布了他的第二张元素周期表。
之后。元素周期表被不断完善。成为化学研究的重要工具,到20世纪初,物理学家们逐步
揭开了原子结构的秘密.人们才逐渐清楚了元素的性质呈周期性变化的原因。问题:
(1)迈尔和门捷列夫进行“族”划分时,运用的是什么科学方法?他们在研究元素原子量与性质的关系时不同之处是什么?
(2)元素周期律的发现对化学科学发展有什么重要意义?(3)举例说明元素周期律对化学知识学习的指导作用。
1868年,化学家迈尔研究已知元素的原子量与其物理性质的关系时。把性质相近的元素划分为一个族.并与l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫研究元素原子量与元素化学性质的关系时,把63种元素排列成几行。同年,他公布了他的第一张元素周期表,后来他汲取了迈尔周期表的优点,进行了更详细的族的划分】分,并于1871年公布了他的第二张元素周期表。
之后。元素周期表被不断完善。成为化学研究的重要工具,到20世纪初,物理学家们逐步
揭开了原子结构的秘密.人们才逐渐清楚了元素的性质呈周期性变化的原因。问题:
(1)迈尔和门捷列夫进行“族”划分时,运用的是什么科学方法?他们在研究元素原子量与性质的关系时不同之处是什么?
(2)元素周期律的发现对化学科学发展有什么重要意义?(3)举例说明元素周期律对化学知识学习的指导作用。
答案:
解析:
(1)化学分类方法。
不同之处在于:迈尔研究的是元素的原子量与其物理性质的关系.门捷列夫研究的是元素
原子量与元素化学性质的关系。
迈尔研究元素原子量与其物理性质的关系时,把性质相近的元素划分为一个族:门捷列夫研究元素原子量与元素化学性质的关系时。把63种元素排列成几行,后来进行了更详细的族的划分。
(2)物理学家们逐步揭开了原子结构的秘密,逐渐清楚了元素的性质呈周期性变化的屑因。形成元素周期表。它是元素周期律的具体表现形式,反映了元素之间的内在联系。元素周其表是学习和研究化学的一种重要工具,我们可以利用元素的性质、它在周期表中的位置和原亏结构三者之间的密切关系来指导我们对化学的研究。
元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索。(3)例如.学习钠、镁、铝与水的反应时.学生可以进行以下实验.

得出结论:金属性强弱Na>Mg>A1
结合原子结构知识解释金属性强弱Na>Mg>A1
同周期元素,自左向右,最外层电子数逐渐增多,原子半径逐渐减小,金属性逐渐减弱。
不同之处在于:迈尔研究的是元素的原子量与其物理性质的关系.门捷列夫研究的是元素
原子量与元素化学性质的关系。
迈尔研究元素原子量与其物理性质的关系时,把性质相近的元素划分为一个族:门捷列夫研究元素原子量与元素化学性质的关系时。把63种元素排列成几行,后来进行了更详细的族的划分。
(2)物理学家们逐步揭开了原子结构的秘密,逐渐清楚了元素的性质呈周期性变化的屑因。形成元素周期表。它是元素周期律的具体表现形式,反映了元素之间的内在联系。元素周其表是学习和研究化学的一种重要工具,我们可以利用元素的性质、它在周期表中的位置和原亏结构三者之间的密切关系来指导我们对化学的研究。
元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索。(3)例如.学习钠、镁、铝与水的反应时.学生可以进行以下实验.

得出结论:金属性强弱Na>Mg>A1
结合原子结构知识解释金属性强弱Na>Mg>A1
同周期元素,自左向右,最外层电子数逐渐增多,原子半径逐渐减小,金属性逐渐减弱。
第3题:
关于元素周期表与周期律,下列说法正确的是
A、元素的性质随着原子量的递增,呈周期性变化
B、在元素周期表中,族序数都等于该元素的原子的最外层电子数
C、在元素周期表中,非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强
D、随着核电荷数的递增,元素原子半径依次增大
E、ⅦA族单质自上而下,随原子量的增大,溶沸点升高
参考答案:E
第4题:
门捷列夫于1871年的《化学元素的周期性依赖关系》发表了第二个化学元素周期表,明确指出:元素的性质和它们的化合物的性质与元素的原子量有周期性的依赖关系,元素的性质是元素原子量的( )。
A.线性函数
B.非线性函数
C.周期函数
D.非周期函数
B.非线性函数
C.周期函数
D.非周期函数
答案:C
解析:
元素的性质是原子量的周期函数。
第5题:
高中化学《元素周期表》
一、考题回顾
题目来源1月6日上午 吉林省白城市面试考题
试讲题目1.题目:元素周期表
2.内容:
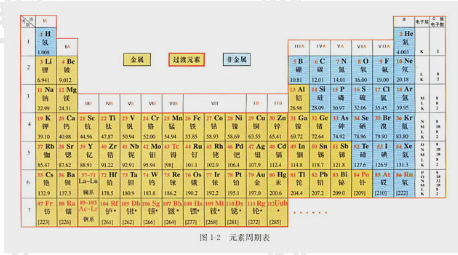
在周期表中,把电子层数相同的元素,按原子序数递增的顺序从左至右排成横行,再把不同横行中最外层电子数相同的元素,按照电子层递增的顺序由上而下排成纵行。
元素周期表有7个横行,叫做周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
在周期表中有些族的元素还有一些特别的名称。例如:
第ⅠA族(除氢):碱金属元素
第ⅦA族:卤族元素
0族:稀有气体元素
3.基本要求:
(1)讲解直观,通俗易懂。
(2)重点讲解元素周期表的特点。
(3)板书工整有条理。
(4)要有提问环节
答辩题目1.简要概述元素周期表中元素的金属性和非金属性变化的规律
2.本节课的教学重难点是什么?
二、考题解析
【教学过程】
(一)故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
(二)新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
【教师提问】从周期表中,大家还可以发现哪些信息?
【学生回答】还可以看出每种原子的元素符号,相对原子质量。
【引导观察】周期表中哪些族有特殊的名称。
【学生回答】第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素
(三)拓展提高
【学生活动】画出前4周期的图,并填上原子。
(四)小结作业
小结:引导学生共同总结本节课的内容。
作业:思考同一周期或者同一主族的元素的化学性质有什么规律。
【板书设计】

1.简要概述元素周期表中元素的金属性和非金属性变化的规律。
2.本节课的教学重难点是什么?
一、考题回顾
题目来源1月6日上午 吉林省白城市面试考题
试讲题目1.题目:元素周期表
2.内容:

在周期表中,把电子层数相同的元素,按原子序数递增的顺序从左至右排成横行,再把不同横行中最外层电子数相同的元素,按照电子层递增的顺序由上而下排成纵行。
元素周期表有7个横行,叫做周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
在周期表中有些族的元素还有一些特别的名称。例如:
第ⅠA族(除氢):碱金属元素
第ⅦA族:卤族元素
0族:稀有气体元素
3.基本要求:
(1)讲解直观,通俗易懂。
(2)重点讲解元素周期表的特点。
(3)板书工整有条理。
(4)要有提问环节
答辩题目1.简要概述元素周期表中元素的金属性和非金属性变化的规律
2.本节课的教学重难点是什么?
二、考题解析
【教学过程】
(一)故事导入
【讲故事】一天清晨,一位年轻人经过一个夜晚的研究后,疲倦地躺在书房的沙发上,他预感十五年来一直萦绕心头的问题即将迎刃而解,因此,这几个星期以来他格外地努力。十五年来,从他学生时代开始就一直对“元素”与“元素”之间可能存在的种种关联感兴趣,并且利用一切时间对化学元素进行研究。最近他感觉自己的研究大有进展,应该很快就能把元素间的关联和规律串在一起了。由于过度疲劳,他在不知不觉中睡着了。睡梦中,他突然清晰地看见元素排列成周期表浮现在他的眼前,他又惊又喜,随即清醒过来,顺手记下梦中的元素周期表。大家知道这个人是谁吗?
【学生回答】门捷列夫。
【教师引导】元素周期表的发现成了一项划时代的成就,而因为在梦中得到灵感,所以人们称为“天才的发现,实现在梦中。”但门捷列夫却不这么认为,把这个累积十五年的成就归功于“梦中的偶然”让他忿忿不平。他说:“在做那个梦以前,我一直盯着目标,不断努力、不断研究,梦中的景象只不过是我十五年努力的结果。”除了学习门捷列夫身上坚持不懈,投身科学的精神,今天我们也要认识他的这项伟大的成就——元素周期表。
(二)新课教学
【学生活动】五分钟时间翻开元素周期表,认识周期表及其中的元素。
【提出问题】周期表的结构是怎样的?周期表中一共有多少种元素?
【学生回答】有7横行,18纵列,总共包含了112种元素。
【教师总结】周期表中收录的是已经发现的元素,但是还有很多未知的元素等待人们去发现,所以周期表的科学性体现于它是在更新的。而在周期表中的横行叫做周期。
【提出问题】一共有几个周期?它们有什么区别?试着写出前3个周期的每个原子的结构示意图,并依次分析。
【学生回答,教师补充】元素周期表有7个周期。每一周期中元素的电子层数相同,从左至右原子序数递增,周期的序数就是该周期元素具有的电子层数。第一周期最短,只有两种元素,第二、三周期各有8种元素,称为短周期;其他周期均为长周期。
【教师提问】周期表中纵行的元素又有什么规律?按照上述同样的方法进行讨论交流。
【学生回答】周期表有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行各为一族。
【教师补充】18纵行总共分为16族,族有主族和副族之分。在周期表中,主族元素的族序数后标A,副族元素的族序数后标B。最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0,因此叫做0族。
【教师提问】从周期表中,大家还可以发现哪些信息?
【学生回答】还可以看出每种原子的元素符号,相对原子质量。
【引导观察】周期表中哪些族有特殊的名称。
【学生回答】第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素
(三)拓展提高
【学生活动】画出前4周期的图,并填上原子。
(四)小结作业
小结:引导学生共同总结本节课的内容。
作业:思考同一周期或者同一主族的元素的化学性质有什么规律。
【板书设计】

1.简要概述元素周期表中元素的金属性和非金属性变化的规律。
2.本节课的教学重难点是什么?
答案:
解析:
1.
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
2.
周期表的知识是对前面学习的知识的整合,是后续学习元素周期律的基础,因此本节课的教学重点是认识周期、主族和副族。
周期表所包含的信息较多,虽然学生在初中有简单的了解过,但是其所包含的信息相对较为抽象,需要一定的基础能力,学生比较难掌握全部,因此本节课的教学难点是能够用元素周期表中的位置来表示元素。
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
2.
周期表的知识是对前面学习的知识的整合,是后续学习元素周期律的基础,因此本节课的教学重点是认识周期、主族和副族。
周期表所包含的信息较多,虽然学生在初中有简单的了解过,但是其所包含的信息相对较为抽象,需要一定的基础能力,学生比较难掌握全部,因此本节课的教学难点是能够用元素周期表中的位置来表示元素。
第6题:
原子—分子论确立之后,化学上又一重大突破是化学元素周期率的发现。对此作出决定性贡献的是()
A.阿佛伽德罗
B.门捷列夫
C.道尔顿
D.吕萨克
参考答案:B
第7题:
阅读下列材料,回答有关问题:
1829年,德国化学家德贝莱纳在研究元素的原子量和化学性质关系时.发现了几个性质相似的元素组,每组包括三种元素,如锂、钠、钾;钙、锶、钡。
1862年,法国地质学家尚古多把元素按其原子量大小顺序标在圆柱体表面的螺旋线上.他发现某些性质相近的元素都出现在一条线上.于是提出元素的性质随其原子量的变化具有周期性。
1868年,化学家迈尔研究了已知元素的原子量和物理性质的关系.把性质相近的元素划分为一族.并于l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫按原子量递增的顺序和元素化学性质的相似性把63种元素排列成几行,当按原子量排序与元素化学性质冲突时,他依据元素的化学性质调整位置.或留下空位。同年,他公布了他的第一张元素周期表。后来,他进行了更详细的族的划分.并于1871年公布了他第二张元素周期表。
之后,元素周期表被不断完善,成为化学研究的重要工具。直到20世纪初.物理学家们逐步揭开了原子结构的秘密,人们才清楚元素的性质呈现周期性变化的根本原因。
问题:
(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是什么?(2分)他们研究的主要区别是什么?(2分)
(2)元素周期律的发现对于化学科学的发展有什么重要意义?(4分)
(3)有人说“元素周期律的发现是物理与化学的完美结合”,结合材料谈谈你对这句话的理解。(2分)请回答元素性质呈现周期性变化的根本原因。(2分)
1829年,德国化学家德贝莱纳在研究元素的原子量和化学性质关系时.发现了几个性质相似的元素组,每组包括三种元素,如锂、钠、钾;钙、锶、钡。
1862年,法国地质学家尚古多把元素按其原子量大小顺序标在圆柱体表面的螺旋线上.他发现某些性质相近的元素都出现在一条线上.于是提出元素的性质随其原子量的变化具有周期性。
1868年,化学家迈尔研究了已知元素的原子量和物理性质的关系.把性质相近的元素划分为一族.并于l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫按原子量递增的顺序和元素化学性质的相似性把63种元素排列成几行,当按原子量排序与元素化学性质冲突时,他依据元素的化学性质调整位置.或留下空位。同年,他公布了他的第一张元素周期表。后来,他进行了更详细的族的划分.并于1871年公布了他第二张元素周期表。
之后,元素周期表被不断完善,成为化学研究的重要工具。直到20世纪初.物理学家们逐步揭开了原子结构的秘密,人们才清楚元素的性质呈现周期性变化的根本原因。
问题:
(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是什么?(2分)他们研究的主要区别是什么?(2分)
(2)元素周期律的发现对于化学科学的发展有什么重要意义?(4分)
(3)有人说“元素周期律的发现是物理与化学的完美结合”,结合材料谈谈你对这句话的理解。(2分)请回答元素性质呈现周期性变化的根本原因。(2分)
答案:
解析:
(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是分类。迈尔研究的是元素的原子量和物理性质的关系.门捷列夫研究的是元素的原子量和化学性质的关系.他们研究的区别在于从不同的角度去认识元素、发现规律。
(2)元素周期律是自然科学的基本规律.元素周期表是元素周期律的具体表现形式.它反映了元素之间的内在联系。是对元素的一种很好的自然分类。我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导化学学习研究。元素周期律和元素周期表为新元素的发现及预测它们的原子结构和性质提供了线索。元素周期律和周期表对工农业生产也有一定的指导作用。由于在周期表中位置靠近的元素性质相近,这启发人们在周期表一定的区域内寻找新的物质.研究制造新品种农药、半导体材料、催化剂等。
(3)从1829年到1871年.人们没有停止对元素周期律的研究,但始终没有解决周期律变化的本质。直到20世纪初.物理学家们逐步揭开了原子结构的秘密.人们才清楚元素的性质呈现周期律变化的根本原因。所以说,元素周期律的发现是物理与化学的完美结合。
元素性质呈现周期性变化的根本原因是核外电子排布呈现周期性变化。
(2)元素周期律是自然科学的基本规律.元素周期表是元素周期律的具体表现形式.它反映了元素之间的内在联系。是对元素的一种很好的自然分类。我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导化学学习研究。元素周期律和元素周期表为新元素的发现及预测它们的原子结构和性质提供了线索。元素周期律和周期表对工农业生产也有一定的指导作用。由于在周期表中位置靠近的元素性质相近,这启发人们在周期表一定的区域内寻找新的物质.研究制造新品种农药、半导体材料、催化剂等。
(3)从1829年到1871年.人们没有停止对元素周期律的研究,但始终没有解决周期律变化的本质。直到20世纪初.物理学家们逐步揭开了原子结构的秘密.人们才清楚元素的性质呈现周期律变化的根本原因。所以说,元素周期律的发现是物理与化学的完美结合。
元素性质呈现周期性变化的根本原因是核外电子排布呈现周期性变化。
第8题:
原子---分子论确立以后,化学上又一个重大的突破是俄国化学家门捷列夫()的发现。
A.元素周期表
B.气体的分压定律
C.元素的化合能力
D.元素的化合价
参考答案:A
第9题:
联合国将2019年定为“国际化学元素周期表年”,下列有关化学元素周期表的说法错误的是:
A.元素周期表共有18列
B.元素周期表是俄国化学家门捷列夫编制的
C.今年是化学元素周期表创建150周年
D.元素周期表中元素是按原子从大到小排列的
B.元素周期表是俄国化学家门捷列夫编制的
C.今年是化学元素周期表创建150周年
D.元素周期表中元素是按原子从大到小排列的
答案:D
解析:
第一步,本题考查化学知识并选错误项。
第二步,化学元素周期表中的化学元素是按照由小到大的顺序排列的,因此选项描述不正确。
因此,选择D选项。
第二步,化学元素周期表中的化学元素是按照由小到大的顺序排列的,因此选项描述不正确。
因此,选择D选项。
第10题:
1869年俄国化学家__________提出了元素周期律并编制了第一个周期表。1871年,他对周期表做出了重要修改,纠正了一些元素的原子量。
答案:
解析:
门捷列夫
