1852年,英国化学家佛兰克兰发现每一种元素的原子同任何其他元素的原子化合时,两者的原子数都有确定的比值,由此提出了元素的()A、元素周期的概念B、化合能力C、反应速度D、变化深度
题目
1852年,英国化学家佛兰克兰发现每一种元素的原子同任何其他元素的原子化合时,两者的原子数都有确定的比值,由此提出了元素的()
- A、元素周期的概念
- B、化合能力
- C、反应速度
- D、变化深度
相似问题和答案
第1题:
A.元素周期表
B.气体的分压定律
C.元素的化合能力
D.元素的化合价
第2题:
元素的化合价就是这种元素的原子与其他元素的原子形成化合物时得失或转移的电子数。( )
此题为判断题(对,错)。
第3题:
关于元素周期表与周期律,下列说法正确的是
A、元素的性质随着原子量的递增,呈周期性变化
B、在元素周期表中,族序数都等于该元素的原子的最外层电子数
C、在元素周期表中,非金属性最强的元素,其最高价氧化物对应水化物的酸性也最强
D、随着核电荷数的递增,元素原子半径依次增大
E、ⅦA族单质自上而下,随原子量的增大,溶沸点升高
第4题:
B.元素周期表是俄国化学家门捷列夫编制的
C.今年是化学元素周期表创建150周年
D.元素周期表中元素是按原子从大到小排列的
第二步,化学元素周期表中的化学元素是按照由小到大的顺序排列的,因此选项描述不正确。
因此,选择D选项。
第5题:
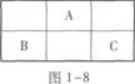

根据题意得:(x+7)+(x+9)=4x,即x=8.
由此可知A是8号元素氧,其元素符号是O,B是15号元素磷,C

第6题:
此题为判断题(对,错)。
第7题:
1852年,英国化学家佛兰克兰发现每一种元素的原子同任何其他元素的原子化合时,两者的原子数都有确定的比值,由此提出了元素的()
A.元素周期的概念
B.化合能力
C.反应速度
D.变化深度
第8题:
关于元素周期律,不正确的说法是
A、元素性质随着核外电子周期性的排布而呈周期性的变化
B、同一周期的元素的第一电离能随着原子序数的递增,由小到大
C、同一周期的元素的原子电负性随着原子序数的递增,由小到大
D、同一周期的元素的原子半径随着原子序数的递增,由大到小
E、同一周期的元素的主要化合价随着原子序数的递增,由小到大
第9题:
1829年,德国化学家德贝莱纳在研究元素的原子量和化学性质关系时.发现了几个性质相似的元素组,每组包括三种元素,如锂、钠、钾;钙、锶、钡。
1862年,法国地质学家尚古多把元素按其原子量大小顺序标在圆柱体表面的螺旋线上.他发现某些性质相近的元素都出现在一条线上.于是提出元素的性质随其原子量的变化具有周期性。
1868年,化学家迈尔研究了已知元素的原子量和物理性质的关系.把性质相近的元素划分为一族.并于l869年制作了他的第一张元素周期表。
1869年,化学家门捷列夫按原子量递增的顺序和元素化学性质的相似性把63种元素排列成几行,当按原子量排序与元素化学性质冲突时,他依据元素的化学性质调整位置.或留下空位。同年,他公布了他的第一张元素周期表。后来,他进行了更详细的族的划分.并于1871年公布了他第二张元素周期表。
之后,元素周期表被不断完善,成为化学研究的重要工具。直到20世纪初.物理学家们逐步揭开了原子结构的秘密,人们才清楚元素的性质呈现周期性变化的根本原因。
问题:
(1)迈尔和门捷列夫根据元素性质进行族的划分所用的科学方法是什么?(2分)他们研究的主要区别是什么?(2分)
(2)元素周期律的发现对于化学科学的发展有什么重要意义?(4分)
(3)有人说“元素周期律的发现是物理与化学的完美结合”,结合材料谈谈你对这句话的理解。(2分)请回答元素性质呈现周期性变化的根本原因。(2分)
(2)元素周期律是自然科学的基本规律.元素周期表是元素周期律的具体表现形式.它反映了元素之间的内在联系。是对元素的一种很好的自然分类。我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导化学学习研究。元素周期律和元素周期表为新元素的发现及预测它们的原子结构和性质提供了线索。元素周期律和周期表对工农业生产也有一定的指导作用。由于在周期表中位置靠近的元素性质相近,这启发人们在周期表一定的区域内寻找新的物质.研究制造新品种农药、半导体材料、催化剂等。
(3)从1829年到1871年.人们没有停止对元素周期律的研究,但始终没有解决周期律变化的本质。直到20世纪初.物理学家们逐步揭开了原子结构的秘密.人们才清楚元素的性质呈现周期律变化的根本原因。所以说,元素周期律的发现是物理与化学的完美结合。
元素性质呈现周期性变化的根本原因是核外电子排布呈现周期性变化。
第10题:
