问答题下列操作对溶液的酸度有何影响? (1)往液NH3中加入Li3N; (2)往KI水溶液中加入HgO; (3)往(NH4)2SO4水溶液中加入CuSO4; (4)往NaOH水溶液中加入Al(OH)3; (5)往H2SO4溶液中加入Na2SO4。
题目
问答题
下列操作对溶液的酸度有何影响? (1)往液NH3中加入Li3N; (2)往KI水溶液中加入HgO; (3)往(NH4)2SO4水溶液中加入CuSO4; (4)往NaOH水溶液中加入Al(OH)3; (5)往H2SO4溶液中加入Na2SO4。
参考答案和解析
正确答案:
(1)NH3+N3-=HN2-+ NH2-,碱性增加
(2)4I-+HgO+H2O = HgI42-+2OH,碱性增加
(3)因生成Cu(NH3)4SO4,使H+增加,酸性增加
(4)因生成Al(OH)4-,碱性减弱
(5)因生成HSO4-,酸性减弱
(2)4I-+HgO+H2O = HgI42-+2OH,碱性增加
(3)因生成Cu(NH3)4SO4,使H+增加,酸性增加
(4)因生成Al(OH)4-,碱性减弱
(5)因生成HSO4-,酸性减弱
解析:
暂无解析
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
一个容器里有若干克盐水。往容器里加入一些水,溶液的浓度变为3%,再加入同样多的水,溶液的浓度变为2%,问第三次加入同样多的水后,溶液的浓度是:
A. 1.8%
B. 1.5%
C. 1%
D. 0.5%
B. 1.5%
C. 1%
D. 0.5%
答案:B
解析:
解题指导: 设浓度为 3%溶液为100克,加入水的质量为x克,则含有盐的质量为100×3%=3克,再加入质量为x的水,则溶液质量为(100+x)克,而因为盐的质量并没有改变,所以溶液的浓度为3÷(100+x)=2%,得x=50克,所以当第三次加入同样多的水的时候,溶液的质量为100+50+50=200克,而且盐的质量仍然没有改变,所以浓度为3÷200×100%=1.5%。故答案为B。
第2题:
往碱溶液中逐滴加入酸溶液,溶液pH逐渐()。
- A、变大
- B、变小
- C、不变
- D、变化不确定
正确答案:B
第3题:
往碱溶液中逐滴加入酸溶液,溶液pH逐渐()。
A.变大
B.变小
C.不变
D.变化不确定
本题答案:B
第4题:
KI溶液中加入[Ag(NH3)2]NO3溶液,能使Ag+形成不溶物而析出;但加入K[Ag(CN)2]溶液后,不能有沉淀形成。为什么?
正确答案: 要点:[Ag(NH3)2]+ ←→ Ag++ 2NH3 Ag+与I-结合生成比[Ag(NH3)2]+更稳定的AgI沉淀. 但[Ag(CN)2]- ←→ Ag++ 2CN- 电离出的Ag+浓度较小使QAGI < Ksp,AgI 不能生成 AgI沉淀.即[Ag(CN)2]- 比 AgI更稳定。
第5题:
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸后,溶液的颜色应该是()。
- A、颜色变浅
- B、逐渐加深
- C、没有改变
- D、变棕黄色
正确答案:B
第6题:
某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究。他们进行了以下实验:
① 往盛有5 mL 5 % H2O2溶液的试管中,伸入带火星的木条,木条不复燃。
② 往盛有5 mL w % H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃。
③ 往盛有5 mL w % H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃。
④ 经检验,②、③ 中反应后试管中仍分别含有a g MnO2和a g Fe2O3。

研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究。下表选取了部分实验数据:

① 往盛有5 mL 5 % H2O2溶液的试管中,伸入带火星的木条,木条不复燃。
② 往盛有5 mL w % H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃。
③ 往盛有5 mL w % H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃。
④ 经检验,②、③ 中反应后试管中仍分别含有a g MnO2和a g Fe2O3。

研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究。下表选取了部分实验数据:

答案:
解析:
(1)催化作用
(2)5 %
(3)相同条件下,MnO2的催化效果比Fe2O3好(1分);在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快。)
(2)5 %
(3)相同条件下,MnO2的催化效果比Fe2O3好(1分);在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快。)
第7题:
往BaCl2和CaCl2的水溶液中分别依次加入:(1)碳酸铵;(2)醋酸;(3)铬酸钾,各有何现象发生?写出反应方程式。
正确答案: BaCl2+(NH4)2CO3=BaCO3↓+NH4Cl
BaCl2+2CH3COOH=Ba(CH3COO)2↓+2HCl
BaCl2+K2CrO4=BaCrO4↓+2KCl
CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl
CaCl2+2CH3COOH=Ca(CH3COO)2↓+ 2HCl
CaCl2+K2CrO4=CaCrO4•2H2O↓+2KCl
第8题:
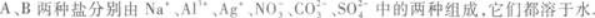
(1)往两种溶液中分别加入盐酸,A溶液不反应,B溶液产生无色无味气体.
(2)往两种溶液中分别加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,B溶液与NaOH不反应.
(3)往两种盐溶液中分别加入BaCl2溶液,都产生白色沉淀.再分别加入稀HNO3,A中沉淀不消失,B中沉淀消失.由此可知,A的化学式为____________,B的化学式为____________.
答案:
解析:
Al2(SO4)3 Na2CO3 【解题指要】 解答此类题目,应熟知各种离子的鉴别反应及反应的特殊现象.另外,分析时应全面照顾,不要漏掉条件.
(1)加入盐酸,B溶液产生无色无味气体.在给出的6种离子中只

即B一定是碳酸盐.
(2)加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,显然这是Al3+的特征反应.其反应方程式为

即A中一定含有Al3+,是铝盐.
(3)向A、B溶液中分别加入BaCl2溶液,都有白色沉淀生成.再分别加入稀HNO3,A中沉淀

(1)加入盐酸,B溶液产生无色无味气体.在给出的6种离子中只

即B一定是碳酸盐.
(2)加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,显然这是Al3+的特征反应.其反应方程式为

即A中一定含有Al3+,是铝盐.
(3)向A、B溶液中分别加入BaCl2溶液,都有白色沉淀生成.再分别加入稀HNO3,A中沉淀

第9题:
含有ⅠA和ⅠB两种离子的混合液,向其中加入氯化钠溶液产生白色沉淀A,过滤分离后,向A中加入氨水部分溶解为无色溶液B,往其中加硝酸产生白色沉淀C,而部分沉淀A加氨水后转化为灰黑色沉淀D.将D溶于硝酸形成无色溶液,往此溶液中加入KI产生桔红色沉淀E.A,B,C,D,E各为何物。
正确答案:A.AgCl和Hg2cl2
B.Ag(NH3)2+
C.AgCl
D.HgNH2Cl和Hg
E.HgI2
第10题:
在Hg(NO3)2溶液中逐滴加入KI溶液,开始有()色()生成
正确答案:桔红;HgI2
