填空题0.25mol/L盐酸吡啶(C5H5NH+Cl-)溶液的pH=()。[已知Kb(C5H5N)=1.7×10-9]
题目
填空题
0.25mol/L盐酸吡啶(C5H5NH+Cl-)溶液的pH=()。[已知Kb(C5H5N)=1.7×10-9]
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
0.1mol/l硫酸羟胺溶液的PH为()。(Kb=9.1*10-9)
A.3.48
B.4.52
C.4.02
D.5.52
参考答案:A
第2题:
浓度为0.1mol/L的某弱酸弱碱盐NH4A溶液pH=7.00,则HA的pKa为( )。
(已知:NH3·H2O的Kb=1.8×10-5)
求计算过程
答案:
NH4A在质子论当作两性物质 [H+]=约=[Ka(NH4+) *Ka(HA)]^1/2 [H+]^2 =Ka(NH4+)* Ka(HA) 而Ka(NH4+)=Kw/Kb(NH3) 因此 [H+]^2 =Kw/ Kb(NH3)* Ka(HA) (10^-7)^2=10^-14 /Kb(NH3)* Ka(HA) 即:Ka(HA)=Kb(NH3)=1.8*10^-5。
第3题:
10.00mL0.200mol/L的氨水与10.00mL0.100mol/L的盐酸混合,则混合液的pH值为()已知Kb=1.8×10-5)。
A、4.74;
B、9.26;
C、10.98;
D、6.12。
参考答案: B
第4题:
试计算10mol/L的稀盐酸溶液的PH值?
正确答案: 因为此溶液为盐酸的极稀溶液此时PH值的计算应考虑溶液中水的电离所产生的[];设水离解产生的[]为Xmol/L,aH+=XmoL/L
则(X+1×10)X=1×10
X+10X-10=0
X=0.995×10
P[OH]=7.002的PH=14-POH=6.998
第5题:
0.25mol/L盐酸吡啶(C5H5NH+Cl-)溶液的pH=()。[已知Kb(C5H5N)=1.7×10-9]
正确答案:2.92
第6题:
0.2mol/l的某碱溶液,其溶液的PH为()。(Kb=4.2*10-4)
A.2.04
B.11.96
C.4.08
D.9.92
参考答案:B
第7题:
等体积混合0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液,混合后溶液的pH=____________.
答案:
解析:
12【解题指要】
(1)设酸和碱溶液的体积均为1 L,则盐酸溶液中含HCl为0.1 mol/L×1 L=0.1 mol;
Ba(OH)2溶液中含Ba(OH)2为0.06 mol/L×l L=0.06 mol.
(2)两溶液混合时,要发生化学反应

因此,混合后可能有以下三种情况:
①恰好完全反应.因BaCl2是强酸强碱盐,所以溶液显中性.
②酸有剩余,溶液显酸性.
③碱有剩余,溶液显碱性.
究竟属于哪一种情况,需经计算才能知道.
设与盐酸完全反应需Ba(OH)2xmol,则

所以Ba(OH)2剩余:0.06 mol-0.05 mol=0.01mol.
(3)计算混合后溶液的pH.

OH一的物质的量浓度为0.005 mol/L×2=0.01mol/L,则
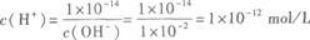
即pH=12.
(1)设酸和碱溶液的体积均为1 L,则盐酸溶液中含HCl为0.1 mol/L×1 L=0.1 mol;
Ba(OH)2溶液中含Ba(OH)2为0.06 mol/L×l L=0.06 mol.
(2)两溶液混合时,要发生化学反应

因此,混合后可能有以下三种情况:
①恰好完全反应.因BaCl2是强酸强碱盐,所以溶液显中性.
②酸有剩余,溶液显酸性.
③碱有剩余,溶液显碱性.
究竟属于哪一种情况,需经计算才能知道.
设与盐酸完全反应需Ba(OH)2xmol,则

所以Ba(OH)2剩余:0.06 mol-0.05 mol=0.01mol.
(3)计算混合后溶液的pH.

OH一的物质的量浓度为0.005 mol/L×2=0.01mol/L,则
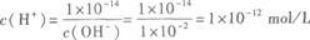
即pH=12.
第8题:
0.1mol/l盐酸羟胺溶液的PH值为()。(Kb=9.1*10-9)
A.3.48
B.4.52
C.4.02
D.5.52
参考答案:A
第9题:
已知氨水中的氨浓度为0.500mol/L,求溶液的pH值(Kb=1.8×10-5)
正确答案: 可应用近似公式求解
=3.0×10-3(mol/L)
pOH=-lg[OH-]=2.52
pH=14.00-pOH=11.48
第10题:
已知NaOH溶液的浓度为400mg/L,求此溶液的pH值。
正确答案: [OH-]=400÷1000÷40=0.01(mol/L)
pOH=-lg[OH-]=-lg0.01=2
pH=14-pOH=14-2=12
此溶液的pH值为12。
