如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
以电对MnO4-/Mn2+与Fe3+/Fe2+组成原电池,已知Φθ(MnO4-/Mn2+)Φθ(Fe3+/Fe2+),则反应物是MnO4-与Fe2+。()
参考答案:正确
第2题:
由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,则电池反应的产物为:
A. Fe3+和Mn2+
B. MnO4-和Fe3+
C. Mn2+和Fe2+
D. MnO4-和Fe2+
B. MnO4-和Fe3+
C. Mn2+和Fe2+
D. MnO4-和Fe2+
答案:A
解析:
提示:电极电势高的电对作正极,电极电势低的电对作负极。正极发生的电极反应是氧化剂的还原反应,负极发生的是还原剂的氧化反应。即
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+
第3题:
由电对MnO4-与Mn2+与Fe3+/Fe2+组成原电池,已知电对MnO4-/Mn2+的φθ大于Fe3+/Fe2+φθ值,若增大溶液的pH,原电池的电动势将:()
A、增大
B、减小
C、不变
D、无法判断
参考答案:B
第4题:
Fe2+还原性比Mn2+强。
正确答案:正确
第5题:
已知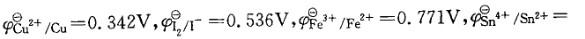 = 0.151V,试判断下列还原剂的还原性由强到弱的是:
= 0.151V,试判断下列还原剂的还原性由强到弱的是:
A. Cu、I- 、Fe2+、Sn2+ B. I-、Fe2+、Sn2+、Cu
C. Sn2+ 、Cu、I-、Fe2+ D. Fe2+、Sn2+、I-、Cu
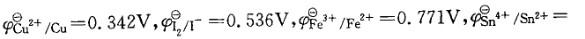 = 0.151V,试判断下列还原剂的还原性由强到弱的是:
= 0.151V,试判断下列还原剂的还原性由强到弱的是:
A. Cu、I- 、Fe2+、Sn2+ B. I-、Fe2+、Sn2+、Cu
C. Sn2+ 、Cu、I-、Fe2+ D. Fe2+、Sn2+、I-、Cu
答案:C
解析:
提示:φΘ值越小,表示电对中还原态的还原能力越强。
第6题:
还原性由强到弱顺序排列的一组物质是( )。
A.Al,Mg,Fe2+
B.Mg,Fe2+,Al
C.Fe2+,Al,Mg
D.Mg,Al,Fe2+
正确答案:D
第7题:
已知E?(Fe3+/Fe2+)=0.77V,E?(MnO4-/Mn2+)=1.51V,当同时提高两电对电极的酸度时,两电对电极电势数值的变化是( )。
A.E?(Fe3+/Fe2+)变小,E?(MnO4-/Mn2+)变大
B.E?(Fe3+/Fe2+)变大,E?(MnO4-/Mn2+)变大
C.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大
D.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)不变
B.E?(Fe3+/Fe2+)变大,E?(MnO4-/Mn2+)变大
C.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大
D.E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)不变
答案:C
解析:
电极电势与物质的本性、物质的浓度、温度有关,一般温度的影响较小。Fe3++e_=Fe2+,与H+浓度无关;MnO4-+8H++5e_=Mn2++4H2O,H+参与了该反应。因此,E?(Fe3+/Fe2+)不变,E?(MnO4-/Mn2+)变大。
第8题:
以电对MnO4-/Mn2+与Fe3+/Fe2+组成原电池,已知Eθ(MnO4-/Mn2+)Eθ(Fe3+/Fe2+),则反应物是()
A、MnO4-与Fe2+
B、MnO4-与Fe3+
C、Mn2+与Fe2
D、Mn2+与Fe3+
参考答案:A
第9题:
由电对MnO4-/Mn2+和电对Fe3+/Fe2+组成原电池,已知φ MnO4-/Mn2+,φ Fe3+/Fe2+,
则电池反应的产物为:
A. Fe3+和Mn2+ B. MnO4-和Fe3+ C. Mn2+和Fe2+ D. MnO4-和Fe2+
则电池反应的产物为:
A. Fe3+和Mn2+ B. MnO4-和Fe3+ C. Mn2+和Fe2+ D. MnO4-和Fe2+
答案:A
解析:
提示:电极电势高的电对作正极,电极电势低的电对作负极。正极发生的电极反应是氧化剂的还原反应,负极发生的是还原剂的氧化反应。即
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+
MnO4-+8H++5e-=Mn2++4H2O
Fe2+-e-=Fe3+
第10题:
Fe2+能加速KMnO4氧化Cl-的反应,这是一种()反应;Mn2+能加速KMnO4氧化C2O42-的反应,这是一种()反应。
正确答案:诱导;自身催化
