单选题在0.1mol·L-1HAc溶液中,存在电离平衡,根据平衡移动原理,下列说法不正确的是()。A 加入浓HAc,由于增加反应物浓度,平衡向右移动,结果HAc解离度增大B 加入少量NaOH溶液,平衡向右移动C 加水稀释,解离度增加D 加入少量HCl,HAc的解离度减少
题目
单选题
在0.1mol·L-1HAc溶液中,存在电离平衡,根据平衡移动原理,下列说法不正确的是()。
A
加入浓HAc,由于增加反应物浓度,平衡向右移动,结果HAc解离度增大
B
加入少量NaOH溶液,平衡向右移动
C
加水稀释,解离度增加
D
加入少量HCl,HAc的解离度减少
参考答案和解析
正确答案:
A
解析:
暂无解析
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
下列水溶液中,沸点最高的是______,凝固点最高的是______。( )
①0.1mol·L-1Hac ②0.1mol·L-1CaCl2
③0.1mol·L-1NaCl ④0.1mol·L-1葡萄糖
①0.1mol·L-1Hac ②0.1mol·L-1CaCl2
③0.1mol·L-1NaCl ④0.1mol·L-1葡萄糖
A.①②
B.②③
C.①③
D.②④
B.②③
C.①③
D.②④
答案:D
解析:
对同浓度的溶液来说,沸点高低顺序为:A2B或AB2型强电解质溶液>AB型强电解质溶液>弱电解质溶液>非电解质溶液;对同浓度的溶液来说凝固点高低顺序相反。因此沸点从低到高的顺序为葡萄糖<HAc<NaCl<CaCl2,凝固点最高的为葡萄糖。
第2题:
由于溶液中有同离子存在而使电离平衡发生移动的现象,称为同离子效应。
A对
B错
对
略
第3题:
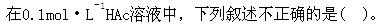
A.加入少量NaOH溶液,HAc电离平衡向右移动
B.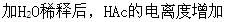
C.加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加
D.加入少量HCl,使HAc电离度减小
B.
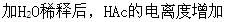
C.加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加
D.加入少量HCl,使HAc电离度减小
答案:C
解析: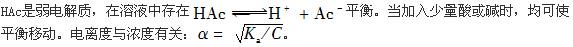
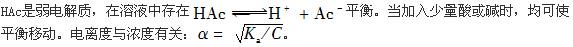
第4题:
在0.1mol·L-1HAc溶液中加入NaCl固体,使其浓度为0.1mol·L-1,溶液中H浓度和HAc的电离度都(),这种作用被称为()
正确答案:增大;盐效应
第5题:
在一定温度下,下列因素中使0.1mol·L-1HAc溶液中pH增加的因素是()
- A、加HCl溶液
- B、加0.1mol·L-1NaCl溶液
- C、加0.1mol·L-1NaAc
- D、加入0.1mol·L-1HAc溶液
正确答案:C
第6题:
在0.1 mol/L的CH3COOH溶液中存在如下电离平衡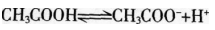 ,对该平衡下列叙述中,正确的是( )。
,对该平衡下列叙述中,正确的是( )。
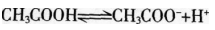 ,对该平衡下列叙述中,正确的是( )。
,对该平衡下列叙述中,正确的是( )。
A.加入水后,平衡向逆反应方向移动
B.加入0.1 mol/L的HCl溶液,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体.平衡向正反应方向移动
B.加入0.1 mol/L的HCl溶液,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体.平衡向正反应方向移动
答案:C
解析:
加水稀释,平衡向右移动,A项错误;加入HCl溶液,引入了H+,平衡向左移动,但c(H+)增大,B项错误;加入少量NaOH固体,中和了部分H+,平衡向右移动,C项正确;加入CH3COONa,。(CH3COOH-)增大。平衡向左移动。D项错误。
第7题:
在一定条件下,电离达到平衡时,下列说法正确的是()。
- A、电离是一种静态平衡
- B、电离是一种动态平衡
- C、分子电离成离子的速度等于离子结合成分子的速度
- D、在同一瞬间内,溶液中的离子和分子的浓度保持不变
正确答案:B,C,D
第8题:
在0.1mol/L HAc溶液中,下列叙述中不正确的是哪一个?
A.加入少量NaOH溶液,HAc电离平衡向右移动
B.加H2O稀释后,HAc的电离度增加
C.加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加
D.加入少量HCl,使HAc电离度减小
B.加H2O稀释后,HAc的电离度增加
C.加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加
D.加入少量HCl,使HAc电离度减小
答案:C
解析:
提示:HAc是弱电解质,存在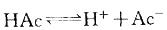 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: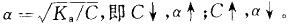 。
。
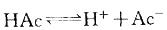 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: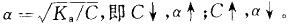 。
。第9题:
强电解质的特点是()
- A、溶液的导电能力较强
- B、在溶液中存在电离平衡
- C、在溶液中不存在分子,完全电离为离子
- D、温度一定,电离常数一定
- E、一般浓度时电离度较小
正确答案:A,C
第10题:
NaAc强烈水解,下列推断有错误的是()。
- A、溶液中[OH-]≈[HAC]
- B、溶液中[H+]相对于[HAC]太少
- C、在平衡体系中不包括水的电离平衡
- D、水溶液中滴入酚酞显红色
正确答案:C
