单选题100毫升0.6mol/L的盐酸加到等体积的0.4mol/L的氢氧化钠溶液中,所得PH值是()A 0.2B 0.7C 1.0D 2.0E 1.5
题目
0.2
0.7
1.0
2.0
1.5
参考答案和解析
相似问题和答案
第1题:
甲、乙、丙3只试管,分别注入同体积的0.1mol/L的盐酸、硫酸和醋酸,再各加入同浓度等体积的氢氧化钠溶液,现测得甲试管中溶液的pH为7,则
A.乙、丙中溶液的pH也为7
B.乙溶液的pH7
C.乙溶液的pH=7,丙溶液pH>7
D.乙溶液的pH7,丙溶液pH<7
甲、乙、丙3只试管加入同浓度等体积的氢氧化钠溶液后的反应产物分别是:NaCI、HSO4-、CH3COONa,其pH分别为7、<7、>7。
第2题:
(1)设酸和碱溶液的体积均为1 L,则盐酸溶液中含HCl为0.1 mol/L×1 L=0.1 mol;
Ba(OH)2溶液中含Ba(OH)2为0.06 mol/L×l L=0.06 mol.
(2)两溶液混合时,要发生化学反应

因此,混合后可能有以下三种情况:
①恰好完全反应.因BaCl2是强酸强碱盐,所以溶液显中性.
②酸有剩余,溶液显酸性.
③碱有剩余,溶液显碱性.
究竟属于哪一种情况,需经计算才能知道.
设与盐酸完全反应需Ba(OH)2xmol,则

所以Ba(OH)2剩余:0.06 mol-0.05 mol=0.01mol.
(3)计算混合后溶液的pH.

OH一的物质的量浓度为0.005 mol/L×2=0.01mol/L,则
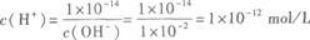
即pH=12.
第3题:
甲、乙、丙三只试管,分别注入同体积的0.1mol/L的盐酸、硫酸和醋酸,再各加入同浓度等体积的氢氧化钠溶液,现测得甲试管中溶液的pH为7,则
A、乙、丙中溶液的pH也为7
B、乙溶液的pH<7,丙溶液pH>7
C、乙溶液的pH=7,丙溶液pH>7
D、乙溶液的pH<7,丙溶液的pH=7
E、乙溶液的pH>7,丙溶液pH<7
第4题:
pH=5的盐酸溶液和pH=12的氢氧化钠溶液等体积混合时,pH值是()。
- A、5.3
- B、7
- C、10.8
- D、11.7
正确答案:D
第5题:
pH=3的盐酸溶液与等体积pH=5的盐酸溶液混合后,pH值等于()
- A、3
- B、4
- C、5
- D、3.3
正确答案:D
第6题:
甲、乙、丙3支试管,分别注入同体积的0.1mol/L的盐酸、硫酸和醋酸,再各加入同浓度等体积的氢氧化钠溶液,现测得甲试管中溶液的pH为7,则
A、乙、丙中溶液的pH也为7
B、乙溶液的pH7
C、乙溶液的pH=7,丙溶液pH>7
D、乙溶液的pH7,丙溶液pH<7
第7题:
甲、乙、丙3支试管,分别注入同体积的0.1mol/L的盐酸、硫酸和醋酸,再各加入同浓度等体积的氢氧化钠溶液,现测得甲试管中溶液的pH为7,则()。
- A、乙溶液的pH<7,丙溶液的pH=7
- B、乙、丙中溶液的pH值也为7
- C、乙溶液的pH=7,丙溶液pH>7
- D、乙溶液的pH<7,丙溶液pH>7
- E、乙溶液的pH>7,丙溶液pH<7
正确答案:D
第8题:
A、1.00
B、3.3
C、8.0
D、9.7
第9题:
pH值为2的盐酸跟pH值为12的氢氧化钠溶液等体积混合后,得到的溶液()。
- A、pH=7
- B、pH>7
- C、pH<7
- D、pH=14
正确答案:A
第10题:
pH=2.0的氢氧化钠和pH=4.0的盐酸溶液等体积混合后,其溶液的pH=3.0。
正确答案:错误
