按熔点高低将下述物质排列起来(用>号连接):NaCl,MgO,CaO,KCl();MgCl2,CaCl2,SrCl2,BaCl2()。
题目
按熔点高低将下述物质排列起来(用>号连接):NaCl,MgO,CaO,KCl();MgCl2,CaCl2,SrCl2,BaCl2()。
参考答案和解析
正确答案:MgO>CaO>NaCl>KCl;MgCl2>CaCl2>SrCl2>BaCl2
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
下列物质的熔点由高到低排列顺序正确的是:
A. HI>HBr>HCl>HF B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO D. SiC>CaO>MgO>SiCl4
A. HI>HBr>HCl>HF B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO D. SiC>CaO>MgO>SiCl4
答案:B
解析:
解:SiC为原子晶体,溶点最高;CaO和MgO为离子晶体,熔点次之;HF、HCl、HBr、HI和SiCl4 为分子晶体,熔点较低。离子晶体中,晶格能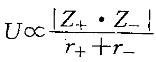 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
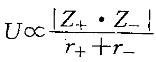 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。第2题:
下列晶格能大小顺序中正确的是哪个?()
- A、CaO>KCl>MgO>NaCl
- B、NaCl>KCl>RbCl>SrO
- C、MgO>RbCl>SrO>BaO
- D、MgO>NaCl>KCl>RbCl
正确答案:D
第3题:
下列物质的熔点由高到低排列顺序正确的是:
A. HI>HBr>HCl>HF
B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO
D. SiC>CaO>MgO>SiCl4
B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO
D. SiC>CaO>MgO>SiCl4
答案:B
解析:
解:SiC为原子晶体,溶点最高;CaO和MgO为离子晶体,熔点次之;HF、HCl、HBr、HI和SiCl4 为分子晶体,熔点较低。离子晶体中,晶格能 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。第4题:
电路原理图是用简明的(),按电路原理将每个系统由上到下合理地连接起来,再将每个系统排列而成。
- A、象形符号
- B、图形符号
- C、符号
正确答案:B
第5题:
下列物质中,熔点最低的是()
- A、NaCl
- B、AlCl3
- C、KF
- D、MgO
正确答案:B
第6题:
下列物质按熔点增高顺序排列,正确的是( )。
A.
B.
C.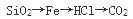
D.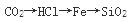
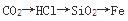
B.
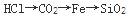
C.
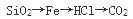
D.
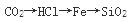
答案:D
解析:

第7题:
根据晶体结构理论和化学键理论,试比较下列各组物质熔点的高低。 (1)ZnCl2、CaCl2、KCl三种晶体 (2)NaBr、NaF、NaCl、NaI四种晶体 (3)NaF、KF、MgO、SiCl4、SiBr4五种晶体
正确答案: (1).CaCl2> KCl > ZnCl2
(2).NaF > NaCl > NaBr > NaI
(3).MgO > NaF > KF > SiCl14> SiBr4
第8题:
下列物质熔点变化顺序中,不正确的是( )。
A.NaF>NaCl>NaBr>NaI
B.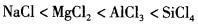
C.LiF>NaCl>KBr>CsI
D.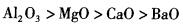
B.
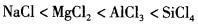
C.LiF>NaCl>KBr>CsI
D.
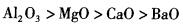
答案:B
解析:
对于离子晶体,半径越小,电荷越多,晶格能越大,熔点越高,在电荷相同时,离子半径越小,离子键越稳定,熔点越高,同一周期自左向右半径逐渐减少,同一主族自上而下半径逐渐增大。
第9题:
下列物质中,何者熔点最低? NaCl KBr KCl MgO
正确答案: KBr熔点最低(因为阴阳离子的半径均大,晶格能小)
第10题:
MgO,CaO,SrO,BaO四种氧化物均为NaCl型晶体,在它们的晶体中正离子半径的大小顺序为(),由此可得出晶格能的大小顺序为(),熔点高低顺序为()。
正确答案:Ba2+>Sr2+>Ca2+>Mg2+;MgO>CaO>SrO>BaO;MgO>CaO>SrO>BaO
