判断下列物质熔点的高低(用>或<表示):NaF()MgO;MgO()BaO;NH3()PH3;PH3()SbH3。
题目
判断下列物质熔点的高低(用>或<表示):NaF()MgO;MgO()BaO;NH3()PH3;PH3()SbH3。
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
下列物质的熔点由高到低排列顺序正确的是:
A. HI>HBr>HCl>HF B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO D. SiC>CaO>MgO>SiCl4
A. HI>HBr>HCl>HF B. HF>HI>HBr>HCl
C. SiC>SiCl4 >CaO>MgO D. SiC>CaO>MgO>SiCl4
答案:B
解析:
解:SiC为原子晶体,溶点最高;CaO和MgO为离子晶体,熔点次之;HF、HCl、HBr、HI和SiCl4 为分子晶体,熔点较低。离子晶体中,晶格能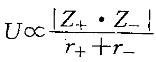 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
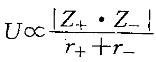 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。第2题:
NaF和MgO中离子的电子构型相同,但MgO的硬度是NaF的两倍,MgO的熔点为2800℃,比NaF的熔点993℃高得多,为什么?
正确答案:NaF和MgO均为离子化合物,其结合力离子键与离子半径、电荷和电子构型有关,NaF和MgO比较,后者离子电荷的乘积比前者大4倍,所以离子间的结合力大,离子键牢固,其硬度和熔点都要大得多。
第3题:
在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组?
A. MgO>CaO>NaF C. CaO>MgO>NaF
B. NaF>CaO>MgO D. NaF>MgO>CaO
B. NaF>CaO>MgO D. NaF>MgO>CaO
答案:A
解析:
提示:影响晶格能的因素主要是离子电荷与离子半径。它们的关系可粗略表示为

在MgO和CaO中,Z+ 、Z- 、r-都相同,不同的是r+ ,由于rMg2+ 2+,所以晶格能: MgO>CaO。在CaO和NaF中,Na与Ca在周期表中处于对角线位置,它们的半径近似相等。虽然ro2-略大于rF- ,但决定晶格能大小的主要因素仍为Z+和Z_。在CaO中Z+与均高于NaF中的Z+与Z- ,所以晶格能CaO>NaF。

在MgO和CaO中,Z+ 、Z- 、r-都相同,不同的是r+ ,由于rMg2+ 2+,所以晶格能: MgO>CaO。在CaO和NaF中,Na与Ca在周期表中处于对角线位置,它们的半径近似相等。虽然ro2-略大于rF- ,但决定晶格能大小的主要因素仍为Z+和Z_。在CaO中Z+与均高于NaF中的Z+与Z- ,所以晶格能CaO>NaF。
第4题:
下列物质中,何者熔点最低? NaCl KBr KCl MgO
正确答案: KBr熔点最低(因为阴阳离子的半径均大,晶格能小)
第5题:
根据晶体结构理论和化学键理论,试比较下列各组物质熔点的高低。 (1)ZnCl2、CaCl2、KCl三种晶体 (2)NaBr、NaF、NaCl、NaI四种晶体 (3)NaF、KF、MgO、SiCl4、SiBr4五种晶体
正确答案: (1).CaCl2> KCl > ZnCl2
(2).NaF > NaCl > NaBr > NaI
(3).MgO > NaF > KF > SiCl14> SiBr4
第6题:
转炉炼钢降低炉渣熔点的有效措施是()。
- A、提高(FeO)
- B、降低(FeO)
- C、适当提高(MgO)
- D、尽量增高(MgO)
正确答案:A,C
第7题:
在下列CaO、MgO、NaF晶格能大小的顺序中,正确的是哪一组?()
- A、MgO>CaO>NaF
- B、NaF>CaO>MgO
- C、CaO>MgO>NaF
- D、NaF>MgO>CaO
正确答案:A
第8题:
在下列CaO、MgO、NaF晶格能中,按从小到大顺序排列的是( )。
A.NA.F、MgO、C.A.O
B.MgO、C.A.O、NA.F
C.NA.F、C.A.O、MgO
D.MgO、NA.F、C.A.O
B.MgO、C.A.O、NA.F
C.NA.F、C.A.O、MgO
D.MgO、NA.F、C.A.O
答案:C
解析:
影响晶格能的因素主要是离子电荷与离子半径
第9题:
下列物质中,熔点最低的是()
- A、NaCl
- B、AlCl3
- C、KF
- D、MgO
正确答案:B
第10题:
MgO的熔点为:()。
- A、1713℃
- B、2600℃
- C、2800℃
- D、1418℃
正确答案:C
