已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应AgCl(s)+2NH3=[Ag(NH3)2]++Cl-的平衡常数为()A、KsKspB、1/KsKspC、Ks/KspD、Ksp/Ks
题目
已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应AgCl(s)+2NH3=[Ag(NH3)2]++Cl-的平衡常数为()
- A、KsKsp
- B、1/KsKsp
- C、Ks/Ksp
- D、Ksp/Ks
参考答案和解析
相似问题和答案
第1题:
利用溶度积规则可以判断沉淀转化的方向,对于反应2AgCl+CrO42-=Ag2CrO4+2Cl-,Kspθ(AgCl)=1.56×10-10,Kspθ(Ag2CrO4)=9.0×10-12,则标准态下该反应应向方向进行。
A、正
B、逆
C、不能确定
第2题:
A.[Ag+][Cl-]
B.Ksp=[Ag+][Cl-]
C.KspAgCl=[Ag+][Cl-]
D.QspAgCl=[Ag+][Cl-]
第3题:
(A)Pt|H2(p)|H2SO4(a)|AgSO4(s)|Ag;
(B)AglAgNO3(a)||K2SO4(a)|PbSO4(s),Pb(s);
(C)Ag(s),Ag2SO4(s)|K2SO4(a)||HCI(a)|AgCl(s),Ag(s);
(D)Ag|AgNO3(a)||H2SO4(a)|Ag2SO4(s),Ag(s)
第4题:
已知ksp,AgCl=1.8×10-10,ksp,Ag2CrO4=2.0×10-12,在Cl-和CrO42+浓度皆为0.10mol/L的溶液中,逐滴加入AgNO3溶液,情况为()。
- A、Ag2CrO4先沉淀
- B、只有Ag2CrO4沉淀
- C、AgCl先沉淀
- D、同时沉淀
正确答案:C
第5题:
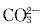 的浓度足够,AgCl(s)可直接转化可为Ag2CO3(s)
的浓度足够,AgCl(s)可直接转化可为Ag2CO3(s)
B AgCl(s)不可能直接转化可为Ag2CO3(s)
C 只要Cl-的浓度足够,Ag2CO3(s)也不可直接转化可为AgCl(s)
D 因无各物质的
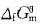 值,故这里不能判断上述反应的方向
值,故这里不能判断上述反应的方向 ①
①
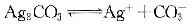 ②
②
 ③
③
对于反应③的平衡常数可由①②求得,其KSP=(1.77×10-10)2/8.45×10-12
△G=-RTlnKSP>0,所以,反应③不会自发进行
第6题:
可以直接用来求Ag2SO4的溶度积的电池是
A、Pt|H2(p)|H2SO4(a)|Ag2SO4(s)|Ag
B、Ag|AgNO3(a)||K2SO4(a)|PbSO4(s),Pb(s)
C、Ag(s),Ag2SO4(s)|K2SO4(a)||HCl(a)|AgCl(s),Ag(s)
D、Ag|AgNO3(a)||H2SO4(a)|Ag2SO4(s),Ag(s)
第7题:
A.S=(Ksp)1/2
B.(Ksp/4)1/2
C.(Ksp)1/3
D.(Ksp/27)1/4
第8题:
A、Kspθ=c(Ag+)c(s2-)
B、Kspθ=c(Ag+)c(s2-)2
C、Kspθ=2c(Ag+)c(s2-)
D、Kspθ=c(Ag+)2c(s2-)
第9题:
25℃时,AgCl的溶解度为0.192×10-3g,其溶度积常数Ksp=()。(AgCl的摩尔质量为143.4)
- A、1.8×10-6
- B、1.8×10-8
- C、1.8×10-10
- D、1.8×10-12
正确答案:C
第10题:
AgCl的溶度积等于1.2×10-10,从Cl-离子浓度为6.0×10-3mol.L-1的溶液中开始生成AgCl沉淀的Ag+离子浓度(mol.L-1)是()
正确答案:2×10-8
