有下列溶液: ①0.01mol·L-1HAc溶液; ②0.01mol·L-1HAc与等体积等浓度的NaOH溶液混合; ③0.01mol·L-1HAc与等体积等浓度的HCl溶液混合; ④0.01mol·L-1HAc与等体积等浓度的NaAc溶液混合。 其pH值排列顺序正确的是()。A、①>②>③>④B、①>③>②>④C、④>③>②>①D、②>④>①>③
题目
有下列溶液: ①0.01mol·L-1HAc溶液; ②0.01mol·L-1HAc与等体积等浓度的NaOH溶液混合; ③0.01mol·L-1HAc与等体积等浓度的HCl溶液混合; ④0.01mol·L-1HAc与等体积等浓度的NaAc溶液混合。 其pH值排列顺序正确的是()。
- A、①>②>③>④
- B、①>③>②>④
- C、④>③>②>①
- D、②>④>①>③
相似问题和答案
第1题:
有下列水溶液:(1)0.01mol·L-1CH3COOH(2)0.01mol·L-1CH3COOH溶液和等体积0.01mol·L-1HCl溶液混合(3)0.01mol·L-1CH3COOH溶液和等体积0.01mol·L-1NaOH溶液混合(4)0.01mol·L-1CH3COOH溶液和等体积0.01mol·L-1NaAc溶液混合则它们的pH值由大到小的正确次序是()
A、(1)(2)(3)(4)
B、(1)(3)(2)(4)
C、(4)(3)(2)(1)
D、(3)(4)(1)(2)
第2题:
B.物质的量浓度相等的H2S和NaHS混合溶液中:
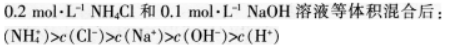
C.
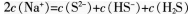
D.将①0.01mol·L-1的CH3COOH溶液;②0.01mol·L-1的盐酸;③pH=12的氨水;④pH=12的NaOH溶液稀释相同倍数后溶液的pH:③>④>②>①
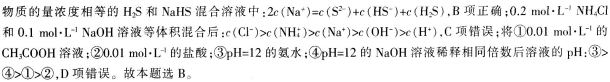
第3题:
A.甲基橙
B.甲基红
C.中性红
D.甲基紫
第4题:
用0.01mol/L的NaOH溶液滴定0.01mol/L HCl溶液时,最合适的指示剂是()。
- A、酚酞(pH=8.2~10.0)
- B、甲基红(pH=4.4~6.2)
- C、甲基橙(pH=3.1~4.4)
- D、酚红(pH=6.4~8.2)
正确答案:D
第5题:
c(NaOH)=0.0001mol/L的NaOH溶液的pH值为();c(HCl)=0.01mol/L的HCl溶液的pH值为()。
10;2
略
第6题:
A.渗透浓度为40mmol·L-1NaCl
B.渗透浓度为10mmol·L-1Na3PO4
C.渗透浓度为400mmol·L-1Na3PO4
D.0.02mol·L-1Na2CO3
第7题:
A. S0>S1>S2>S3 B. S0>S2>S1>S3 C. S0>S1>S2=S3 D. S0>S2>S3>S1
第8题:
此题为判断题(对,错)。
第9题:
高硬度的测定用0.01mol/L的EDTA标准滴定溶液进行滴定。
正确答案:正确
第10题:
100mL 0.1mol/L HCL加到100mL 0.01mol/L NaOH溶液中可生成中性的NaOH溶液。
正确答案:正确
