活化能是化学反应速率相对于()的敏感程度。A、温度变化B、平衡常数C、反应热D、浓度变化
题目
活化能是化学反应速率相对于()的敏感程度。
- A、温度变化
- B、平衡常数
- C、反应热
- D、浓度变化
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
一般温度升高,化学反应速率加快。如果活化能越大,则反应速率受温度的影响也越大。()
此题为判断题(对,错)。
参考答案:正确
第2题:
对一个化学反应来说,下列叙述正确的是( )。
A.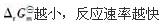
B.
C.活化能越小,反应速率越快
D.活化能越大,反应速率越快
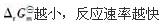
B.

C.活化能越小,反应速率越快
D.活化能越大,反应速率越快
答案:C
解析:

第3题:
对于一个化学反应来说,下列说法正确的是()。
A.放热越多,反应速率越快。
B.活化能越小,反应速率越快。
C.平衡常数越大,反应速率越快。
D.△rGmθ越大,反应速率越快。
参考答案:B
第4题:
在化学反应中,催化剂的作用在于()
- A、降低反应活化能
- B、增加反应活化能
- C、增大反应的平衡常数
- D、增大正向反应速率
正确答案:A
第5题:
对于一个化学反应,下列说法中正确的是()
- A、加入催化剂只能使正反应速率越大
- B、加入催化剂只能使逆反应速率越大
- C、活化能越大,反应速率越大
- D、活化能越小,反应速率越大
正确答案:D
第6题:
反应的活化能是什么?它是怎样影响化学反应速率的?为什么有些反应的活化能很接近,反应速率却相差很大、但有些反应的活化能相差较大,反应速率却很接近?
答案:反应的活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量。
化学反应速率与其活化能的大小密切相关。活化能越低,反应速率越快,因此降低活化能会有效地促进反应的进行。
从碰撞理论给出的公式k=Ae-Ea/RT 可以看出,Ea以指数关系影响速率常数k值,它的确是影响反应速率的重要因素,但A也影响k值。对不同的反应,A对k的影响很大,所以活化能不是决定反应速率的唯一因素。
第7题:
对一个化学反应来说,下列叙述正确的是:
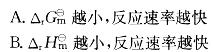
C. 活化能越小,反应速率越快
D. 活化能越大,反应速率越快
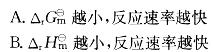
C. 活化能越小,反应速率越快
D. 活化能越大,反应速率越快
答案:C
解析:
提示 由阿仑尼乌斯公式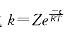 可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。
可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。
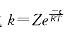 可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。
可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。第8题:
对于一个化学反应,下列说法正确的是()
A、△rGmθ越负,反应速率越快。
B、△rHmθ越负,反应速率越快。
C、活化能越大,反应速率越快。
D、活化能越小,反应速率越快。
参考答案:D
第9题:
化学反应的活化能愈大,下列什么因素对化学反应速率的影响较大()
- A、反应物的浓度
- B、压力
- C、反应的级数
- D、温度
正确答案:D
第10题:
决定化学反应速率大小的内因是()
- A、温度
- B、活化能
- C、催化剂
- D、内能
正确答案:B
