某第4周期元素,当该元素原子失去一个电子成为正1价离子时,该离子的价层电子排布式为3d10,则该元素的原子序数为()。A、19B、24C、29D、36
题目
某第4周期元素,当该元素原子失去一个电子成为正1价离子时,该离子的价层电子排布式为3d10,则该元素的原子序数为()。
- A、19
- B、24
- C、29
- D、36
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中不正确的是( )。
A.外层电子排布为3d54s1
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸
答案:C
解析:
根据题意,最高氧化数为+6的元素有VIA族和VIB族元素;而已知最外层只有一个电子,故只能是VIB族元素;在由已知中最后一个条件“原子半径是同族元素中最小的”,可确定该元素是VIB组中的Cr,Cr的电子排布式为

,可得出以下结论:
外层电子排布
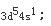
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为

Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。

,可得出以下结论:
外层电子排布
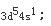
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为

Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。
第2题:
某元素最高正价与负价绝对值之差为4,该元素的离子与跟其核外电子排列相同的离子形成的化合物是()
- A、K2S
- B、MgO
- C、MgS
- D、NaF
正确答案:A
第3题:
某元素的原子序数小于36,当该元素原子失去一个电子时,其副量子数等于2的轨道内电子数为全充满,则该元素为()
A、Cr
B、K
C、Br
D、Cu
参考答案:D
第4题:
某元素的基态价层电子构型为5d66s2,请给出比该元素的原子序数小4的元素的基态原子电子组态。
正确答案: 按构造原理,该元素的基态电子组态为[Xe]4f145d24s2。
第5题:
已知某元素+2价离子的核外电子排布式为:[Ar]3d5,该元素在周期表中处于()周期、()族、()区,元素符号是()。
正确答案:第四;ⅦB;d;Mn
第6题:
某元素位于第4周期IB,则该元素原子外层电子排布式是( )。
A. 3d94s2 B. 3d104s2 C. 3d104s1 D. 3d105s1
A. 3d94s2 B. 3d104s2 C. 3d104s1 D. 3d105s1
答案:C
解析:
提示:第4周期IB元素的外层电子构型为(n-1)d10ns1,第4周期元素n=4,因此其外层电子排布式为3d104s1。
第7题:
某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答: 该元素的原子序数,符号,所处周期和族。
正确答案: 原子系数为27,元素符号为Co,第4周期,第Ⅷ族
第8题:
某元素处在周期表的第三周期,该元素原子的电子层为( )
A.1
B.3
C.2
D.4
参考答案:B
第9题:
当n=4时,该电子层电子的最大容量为()个;某元素原子在n=4的电子层上只有2个电子,在次外层l=2的轨道中有10个电子,该元素符号是(),位于周期表中第四周期,第()族,其核外电子排布式为()。
正确答案: 32;Zn;ⅡB;1s22s22p63s23p63d104s2
第10题:
某元素的非金属性强,一般是指()。
- A、该元素的原子易火去电子的趋势强
- B、该元素的原子易得到电子的趋势强
- C、该元素的原子最外层电子数少于4个
- D、该元素的原子很活泼
正确答案:B
