已知某元素为第四周期元素,其二价离子的外层有18个电子,则该元素的原子序数为(),元素符号为(),在周期表中的()区,第()族。
题目
已知某元素为第四周期元素,其二价离子的外层有18个电子,则该元素的原子序数为(),元素符号为(),在周期表中的()区,第()族。
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中不正确的是( )。
A.外层电子排布为3d54s1
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸
B.该元素为第四周期、ⅥB族元素铬
C.+3价离子的外层电子排布式为3d24s1
D.该元素的最高价氧化物的水合物为强酸
答案:C
解析:
根据题意,最高氧化数为+6的元素有VIA族和VIB族元素;而已知最外层只有一个电子,故只能是VIB族元素;在由已知中最后一个条件“原子半径是同族元素中最小的”,可确定该元素是VIB组中的Cr,Cr的电子排布式为

,可得出以下结论:
外层电子排布
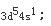
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为

Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。

,可得出以下结论:
外层电子排布
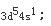
因为周期数等于电子层数,等于最高主量子数,即第四周期。他的最后一个电子填充在d亚层上,所以它是副族元素,其族数等于[(n-1)d+ns]电子层上的电子数,对Cr来讲为5+1=6,即ⅥB族元素;
因为原子失去电子时,首先失去最外层上的电子,继而再失去次外层上的d电子。所以+3价离子的外层电子排布为

Cr的最高价氧化物CrO3,其水合物为H2CrO4或H2Cr2O7均为强酸。
第2题:
已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符号:
(1)第四周期第Ⅳ 族_______;
族_______;
(2)第五周期第Ⅵ 族_______。
族_______。
(1)第四周期第Ⅳ
 族_______;
族_______;
(2)第五周期第Ⅵ
 族_______。
族_______。答案:
解析:
Ti:3d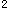 4s
4s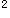 Te:5s
Te:5s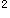 5p
5p
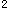 4s
4s Te:5s
Te:5s 5p
5p
第3题:
某元素原子的最外层电子构型为4s24p5,请写出该元素的名称、在周期表中的具体位置。
参考答案:此元素为溴Br,在第四周期,第ⅦA族
第4题:
某短周期元素的最外层电子数比次外层电子数少3个,该元素气态氢化物中的化合价为()
- A、+5价
- B、-3价
- C、-2价
- D、+3价
正确答案:B
第5题:
当n=4时,该电子层电子的最大容量为()个;某元素原子在n=4的电子层上只有2个电子,在次外层l=2的轨道中有10个电子,该元素符号是(),位于周期表中第四周期,第()族,其核外电子排布式为()。
正确答案: 32;Zn;ⅡB;1s22s22p63s23p63d104s2
第6题:
根据右表提供的信息,下列判断正确的是
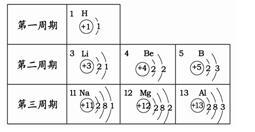

A.元素所在的周期数等于其原子的最外层电子数
B.钠离子核外有三个电子层
C.第二、三周期元素的原子从左至右最外层电子数逐渐增多
D.在化学变化中镁元素容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
B.钠离子核外有三个电子层
C.第二、三周期元素的原子从左至右最外层电子数逐渐增多
D.在化学变化中镁元素容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
答案:C
解析:
第7题:
已知某元素+2价离子的核外电子排布式为:[Ar]3d5,该元素在周期表中处于()周期、()族、()区,元素符号是()。
正确答案:第四;ⅦB;d;Mn
第8题:
某第4周期的元素,当该元素原子失去一个电子成为正1价离子时,该离子的价层电子排布式为3d10则该元素的原子序数是:
A. 19
B. 24
C.29
D. 36
B. 24
C.29
D. 36
答案:C
解析:
原子首先失去最外层电子,使电子层数减小而使离子稳定。所以失去的为4s上的一个电子,该原子价电子构型为3d104s1,为29号Cu原子的电子构型。
第9题:
某元素的金属性强,一般是指()。
- A、该元素的原子失去电子而成为阳离子的趋势强
- B、该元素有较大的硬度
- C、该元素有金属光泽
- D、该元素的最外层电子数多于4个
正确答案:A
第10题:
若某基态原子的外围电子排布为4d15s2,则下列说法正确的是()
- A、该元素基态原子中共有3个电子
- B、该元素原子核外有5个电子层
- C、该元素原子最外层共有3个电子
- D、该元素原子M能层共有8个电子
正确答案:B
