单选题常温下,在CH3COOH和CH3COONa的混合溶液中,若它们的浓度均为0.10mol·L-1,测得pH值是4.75,现将此溶液与等体积的水混合后,溶液的pH值是( )。[2010年真题]A 2.38B 5.06C 4.75D 5.25
题目
2.38
5.06
4.75
5.25
相似问题和答案
第1题:
A、NaOH
B、CH3COOH
C、CH3COONa
D、CH3COONa—CH3COOH
第2题:
【题目描述】
13.下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO2-4)>c >c(OH-)=c(H+)
B.0.1 mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+C(H+)
正确答案:AC
第3题:
下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO2-4)>c >c(OH-)=c(H+)
B.0.1 mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+C(H+)
第4题:
B.物质的量浓度相等的H2S和NaHS混合溶液中:
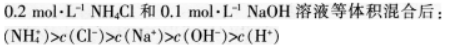
C.
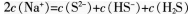
D.将①0.01mol·L-1的CH3COOH溶液;②0.01mol·L-1的盐酸;③pH=12的氨水;④pH=12的NaOH溶液稀释相同倍数后溶液的pH:③>④>②>①
第5题:
(已知
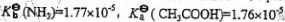 )
)
(A)NH4Cl (B)NH3
(C)CH3COOH (D)CH3COOH+CH3COONa
第6题:
A、NaAc溶液(Ka=1.76×10-5)
B、NH₃H₂O溶液(Kb=1.78×10-5)
C、K₂S溶液(K₂=7.1×10-15)
D、HCN溶液(Ka=4.0×10-10)
第7题:
B.4.75
C.4.60
D.9.25
第8题:

第9题:
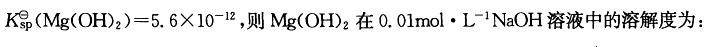
A.5.6×10-9 mol*L-1 B.5.6 ×10-10 mol*L-1
C.5.6×10-8 mol*L-1 D.5.6×10-5 mol*L-1
38. BeCl2中Be的原子轨道杂化类型为:
A.sp B.sp2 Csp3 D.不等性Sp3
39.常温下,在CH3COOH与CH3COONa的混合溶液中,若它们的浓度均为0. 10mol*L-1,测得pH是4.75,现将此溶液与等体积的水混合后,溶液的pH值是:
A.2.38 B.5.06 C.4.75 D.5.25
40.对一个化学反应来说,下列叙述正确的是:

41. 26号元素原子的价层电子构型为:
B.3d64s2
C.3d6
D.4s2
第10题:
B. 5. 06
C. 4. 75
D. 5. 25
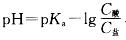 ,溶液稀释pH不变。
,溶液稀释pH不变。