在NaCl、MgCl2、AlCl3、SiCl4四种物质的晶体中,离子极化作用最强的是( )。 A.NaCl B.MgCl2 C.AlCl3 D.SiCl4
题目
在NaCl、MgCl2、AlCl3、SiCl4四种物质的晶体中,离子极化作用最强的是( )。
A.NaCl
B.MgCl2
C.AlCl3
D.SiCl4
B.MgCl2
C.AlCl3
D.SiCl4
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
下列化合物中,键的极性最大的是:
A. AlCl3 B. PCl3 C. MgCl2 D. CaCl2
A. AlCl3 B. PCl3 C. MgCl2 D. CaCl2
答案:D
解析:
提示:四种物质同为氯化物。电负性最小或电离能小,则金属性强,键的极性大。
第2题:
在500ml溶液里含NaCl和MgCl2各0.1mol,则该溶液中Cl-的物质的量浓度为()。
- A、0.6mol/L
- B、0.3mol/L
- C、0.2mol/L
- D、0.1mol/L
正确答案:B
第3题:
下列化合物中,正负离子间附加极化作用最强的是:()
A、AgF
B、AgCl
C、AgBr
D、AgI
参考答案:D
第4题:
可以用()溶液作试剂来鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液。
- A、NaOH
- B、Na2S04
- C、NaN03
- D、NaCl
正确答案:A
第5题:
根据晶体结构理论和化学键理论,试比较下列各组物质熔点的高低。 (1)ZnCl2、CaCl2、KCl三种晶体 (2)NaBr、NaF、NaCl、NaI四种晶体 (3)NaF、KF、MgO、SiCl4、SiBr4五种晶体
正确答案: (1).CaCl2> KCl > ZnCl2
(2).NaF > NaCl > NaBr > NaI
(3).MgO > NaF > KF > SiCl14> SiBr4
第6题:
碱金属中()离子的极化力最强,()变形性最大
正确答案:Li+;Cs+
第7题:
下列物质中,不能由金属和氯气反应制得的是()
- A、MgCl2;
- B、AlCl3;
- C、FeCl2;
- D、CuCl2
正确答案:C
第8题:
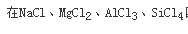
四种物质中,离子极化作用最强的是( )
。

答案:D
解析:
电负性很小的金属原子和电负性很大的非金属原子相互靠近时,金属原子失去电子形成正离子,非金属原子得到电子形成负离子,由正、负离子靠静电引力形成的化学键称离子键。离子在外电场或另一离子作用下,发生变形产生诱导偶极的现象叫离子极化。电荷数越多,极化力越强。半径越小,极化力越强。Na、Mg、Al、Si四种元素为同一周期元素,Si电荷最多且半径最小,因此
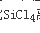
离子极化作用最强。
电负性很小的金属原子和电负性很大的非金属原子相互靠近时,金属原子失去电子形成正离子,非金属原子得到电子形成负离子,由正、负离子靠静电引力形成的化学键称离子键。离子在外电场或另一离子作用下,发生变形产生诱导偶极的现象叫离子极化。电荷数越多,极化力越强。半径越小,极化力越强。Na、Mg、Al、Si四种元素为同一周期元素,Si电荷最多且半径最小,因此
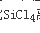
离子极化作用最强。
第9题:
NaCl、MgCl2、AlCl3三种物质的熔点依次降低,表明键的共价程度依次增大。
正确答案:正确
第10题:
MgO,CaO,SrO,BaO四种氧化物均为NaCl型晶体,在它们的晶体中正离子半径的大小顺序为(),由此可得出晶格能的大小顺序为(),熔点高低顺序为()。
正确答案:Ba2+>Sr2+>Ca2+>Mg2+;MgO>CaO>SrO>BaO;MgO>CaO>SrO>BaO
