下述分子中的中心原子采取sp3等性杂化的是()A、CH3ClB、NH3C、H2OD、PH3
题目
下述分子中的中心原子采取sp3等性杂化的是()
- A、CH3Cl
- B、NH3
- C、H2O
- D、PH3
如果没有搜索结果,请直接 联系老师 获取答案。
如果没有搜索结果,请直接 联系老师 获取答案。
相似问题和答案
第1题:
在下列物质的分子中,中心原子采用sp杂化轨道成键,分子空间构型是直线型的是( )。
A.
B.
C.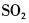
D.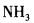

B.

C.
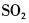
D.
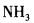
答案:A
解析:
见杂化轨道类型。中心原子Be采用sp杂化与Cl原子成键。
第2题:
PCl3分子空间几何构型及中心原子杂化类型分别为:
A .正四面体,sp3杂化
B.三角锥型,不等性sp3杂化
C .正方形,dsp2杂化
D .正三角形,sp2杂化
B.三角锥型,不等性sp3杂化
C .正方形,dsp2杂化
D .正三角形,sp2杂化
答案:B
解析:
提示 P和N为同主族元素,PCl3中P的杂化类型与NH3中的N原子杂化类型相同,为不等性sp3杂化,四个杂化轨道呈四面体型,有一个杂化轨道被孤对电子占据,其余三个杂化轨道与三个Cl原子形成三个共价单键,分子为三角锥型。
第3题:
PCl3分子空间几何构型及中心原子杂化类型分别为:
A.正四面体,sp3杂化
B.三角锥型,不等性sp3杂化
C.正方形,dsp2杂化
D.正三角形,sp2杂化
B.三角锥型,不等性sp3杂化
C.正方形,dsp2杂化
D.正三角形,sp2杂化
答案:B
解析:
提示:P和N为同主族元素,PCl3中P的杂化类型与NH3中的N原子杂化类型相同,为不等性sp3杂化,四个杂化轨道呈四面体型,有一个杂化轨道被孤对电子占据,其余三个杂化轨道与三个Cl原子形成三个共价单键,分子为三角锥形。
第4题:
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()。
- A、直线形,sp杂化
- B、三角形,sp2杂化
- C、三角锥形,sp2杂化
- D、三角锥形,sp3杂化
正确答案:D
第5题:
下列分子中,中心原子成键时采用等性sp3杂化的是()
- A、H2O
- B、NH3
- C、SO3
- D、CH4
正确答案:D
第6题:
下列各种说法中正确的是?
A.凡是中心原子采用sp3杂化轨道成键后形成的分子,其空间构型都是正四面体
B.凡AB3型的共价化合物,其中心原子均采用sp2杂化轨道成键
C.在AB2型的共价化合物中,中心原子均采用sp杂化轨道成键
D. sp3杂化可分等性sp3杂化和不等性sp3杂化
A.凡是中心原子采用sp3杂化轨道成键后形成的分子,其空间构型都是正四面体
B.凡AB3型的共价化合物,其中心原子均采用sp2杂化轨道成键
C.在AB2型的共价化合物中,中心原子均采用sp杂化轨道成键
D. sp3杂化可分等性sp3杂化和不等性sp3杂化
答案:D
解析:
提示:通过sp杂化后形成的分子为直线;通过sp2杂化后形成的分子为正三角形,也有V字形的;通过SP3杂化后形成的分子有正四面体、三角锥形,还有V字形。
第7题:
下列各分子中,中心原子为sp3杂化的是:()
- A、H2O
- B、BF3
- C、SiCl4
- D、PCl3
正确答案:C
第8题:
在OF2分子中,氧原子成键的杂化轨道是下列中哪种杂化轨道?
A. sp3杂化
B. sp杂化
C.sp2杂化
D.sp3不等性杂化
B. sp杂化
C.sp2杂化
D.sp3不等性杂化
答案:D
解析:
提示:考查如何判断中心原子的杂化类型。
第9题:
乙炔分子(C2H2)中,碳原子采取的是()。
- A、sp2杂化
- B、等性sp3杂化
- C、sp杂化
- D、不等性sp3杂化
正确答案:C
第10题:
据杂化轨道理论,H2S分子的杂化方式是()。
- A、sp等性杂化
- B、sp2 不等性杂化
- C、sp3等性杂化
- D、sp3不等性杂化
正确答案:D
